👉Enunciado: Una muestra de bifenilo ((C6H5)2) que pesaba 0.526 g se encendió en un calorímetro de bomba inicialmente a 25 °C, produciendo un aumento de temperatura de 1.91 K. En un experimento de calibración separado, se determinó que la capacidad calorífica del calorímetro fue de 11.24 kJ/K. Utilice esta información para determinar la entalpía estándar de combustión de bifenilo.
|| Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
👉Solución: Aplicamos la definición de entalpía en términos de calor específico, y expresamos en términos de la masa.
La masa molar del
bifenilo es 154.2 g/mol. También necesitaremos una ecuación química balanceada.
2(C6H5)2(s)+29O2(g)→24CO2(g)+5H2O(l)
👉Otros
enunciados: Halle la entalpía real de la combustión de 0.526 g teniendo en cuenta
el efecto de los gases, Hallar la entalpía real de la combustión de
0.526 g teniendo en cuenta el efecto de los gases,
👉Temas: química, química general, Termoquímica, joseleg, calor, capacidad
calorífica, calor específico, calorímetro de presión constante


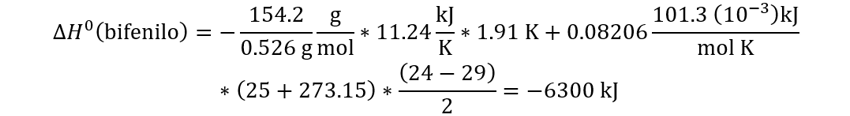

No hay comentarios:
Publicar un comentario