(Ciencias de Joseleg) (Química) (Química cuantitativa) (Disoluciones
y propiedades coligativas) (Ejercicios) (Introducción) (Generalidades) (Mezclas
homogéneas y heterogéneas) (Mezclas
homogéneas o disoluciones) (Tipos
de disoluciones) (Introducción
a las unidades de concentración) (Porcentaje
en masa) (Notación
partes por) (Porcentaje
volumen a volumen) (Porcentaje
masa a volumen) (Concentración
molar) (Concentración
normal) (Peso
equivalente y factor equivalente) (Concentración
molal) (Fracción
molar) (Conversiones
entre unidades de concentración líquidas)
(Unidades
de concentración en gases) (Conversiones
de unidades de concentración gaseosas)
(Cambios
de concentración subcríticos) (Alícuotas,
destilaciones y mezclas) (Referencias
bibliográficas)
Describe la masa del soluto en gramos para exactamente 100 g
de solución. Normalmente la conocemos como porcentaje en masa de soluto a masa
de solución %mm,
pero la expresión porcentaje en peso es de uso común en las pruebas de estado y
libros de texto. En el cálculo del porcentaje de masa, las unidades de masa del
soluto y de la solución deben ser las mismas. Si la masa del soluto se da en
gramos, entonces la masa de la solución también debe ser gramos.
(3)
Aunque tendemos a usarla en términos de un porcentaje, el
significado original de esta unidad es el de una fracción simple, y recibe el
nombre de fracción de masas, la cual puede adoptar símbolos como
(4)
Adoptaremos de aquí en adelante la simbología aconsejada por
el libro dorado de la IUPAC (http://goldbook.iupac.org/terms/view/M03722),
nombrando estas unidades como fracción de masas (wi) y al porcentaje en masa lo nombraremos empleando la
notación partes por ciento en masa (ppcwi)
o (%mi), siendo partes por
ciento en este caso.
Dada la ecuación fundamental para la fracción de masas, podemos
afirmar que es una unidad adimensional, pero su versión porcentual tendrá
pseudo-unidades %, que, aunque formalmente también se considera adimensional,
en la práctica funciona como una unidad que debe tomarse en cuenta durante el
análisis dimensional.
(5)
Para facilitar las soluciones numéricas lo más conveniente
es convertir implícitamente los porcentajes a fracciones dividiendo entre 100% para
no usar el % como unidad en la fórmula, y solo emplearlo al expresar respuestas
textuales.
Tanto la fracción de masas, como la fracción de masas
porcentual tienen como numerador a la masa total de la solución, que denotamos
como (m). Sin embargo, la masa total
será igual a la suma de las sustancias empleadas para hacer la solución.
(6)
Sin embargo, asumiremos un solo soluto y un solo solvente:
(7)
La forma auxiliar puede igualarse con la definición de
fracción de masas:
(8)
Masa del soluto en términos la masa total y la fracción de
masas.
(9)
Masa total
en términos de la fracción de masas y la masa del soluto
(10)
Fracción de
masas en términos de la masa del soluto y del solvente
(11)
Masa del soluto en términos de la fracción de masas y la
masa del solvente.
(12)
Masa del solvente en términos de la fracción de la masa del
soluto y la fracción de masas.
(13)
Porcentaje en masa en términos de la fracción de masa
(14)
Fracción de masa en términos del porcentaje en masa.
(15)
Partes por millón en términos de la fracción de masa.
(16)
Fracción de masa en términos de partes por millón.
(17)












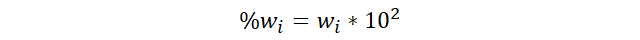




No hay comentarios:
Publicar un comentario