(Ciencias de Joseleg)
(Química)
(Química cuantitativa)
(Termoquímica)
(Ejercicios) (Introducción) (Energía)
(Sistema,
alrededores y calor) (Primera
ley de la termodinámica) (Entalpía)
(Entalpía
de la reacción) (Capacidad
calorífica y calor específico) (Calorimetría
a presión constante) (Calorimetría
a volumen constante) (Ley
de Hess) (Entalpía
de formación) (Termoquímica
de los alimentos) (Termoquímica
de los combustibles) (Referencias
bibliográficas)
Las técnicas y equipos empleados en calorimetría dependen de la naturaleza
del proceso que se estudia. Para muchas reacciones, como las que ocurren en
solución, es fácil controlar la presión para que se mida ∆H
directamente.
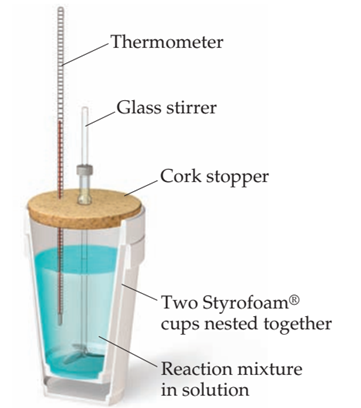
Figura 10‑1. Calorímetro de taza de café. Este simple aparato se usa para medir los cambios de temperatura de las reacciones a presión constante. Este es el tipo de calorímetro más común para los experimentos escolares.
AAunque los calorímetros utilizados para trabajos de alta precisión son instrumentos de precisión, un simple calorímetro de "taza de café"; (Figura 10‑1) se usa a menudo en laboratorios de química general para ilustrar los principios de la calorimetría. Debido a que el calorímetro no está sellado, la reacción ocurre bajo la presión esencialmente constante de la atmósfera.
Para un cuerpo inerte
La calorimetría para un cuerpo inerte se
fundamenta en el flujo de calor entre dos cuerpos, uno incógnita o variable, y
el otro el dato o conocido, que generalmente es agua. El punto es que el cuerpo
inerte NO reacciona químicamente con el agua, y solo comparte físicamente calor
con esta. Ahora pasemos al modelo matemático:
👉Enunciado: Hallar las funciones que
permitan describir un calorímetro de presión constante en términos de dos cuerpos
que comparten calor pero que no pueden hacerlo con el ambiente o con el propio
calorímetro, y que no reaccionan químicamente, de forma tal que podamos
calcular las temperaturas iniciales, la temperatura de equilibrio, la capacidad
calorífica y la masa.
Podemos
extraer las siguientes funciones clave.
Como se mencionó en la demostración, la
sustancia (d) generalmente es agua, pero no siempre es el caso, por lo que
deberá adaptar las identidades para situaciones que implican diseños
experimentales aparentemente diferentes, pero que encajan en el mismo modelo
matemático. En otras ocasiones el enunciado se organiza de forma tal que el
agua es la sustancia con menos términos conocidos, por lo que las definiciones
se invierten.
👉Enunciado: Se colocó una pastilla de plomo (Pb) que
tenía una masa de 26.47 g a 89.98 °C en un calorímetro de presión constante de
capacidad calorífica insignificante que contenía 100.0 ml de agua. La
temperatura del agua pasó de 22.50 °C a 23.17 ° C. ¿Cuál es el calor específico
del gránulo de plomo? // Pulse aquí.
👉Enunciado: Una bola de rodamiento de acero inoxidable de
30.14 g a 117.82 °C se coloca en un calorímetro de presión constante que
contiene 120.0 mL de agua a 18.44 °C. Si el calor específico del rodamiento es
0.474 J / g ° C, calcule la temperatura final del agua. Suponga que el
calorímetro tiene una capacidad calorífica insignificante // Pulse aquí.
👉Enunciado: Una bola de rodamiento de acero inoxidable de
30.14 g se colocará en un calorímetro de presión constante que contiene 120.0
mL de agua a 18.44 °C. Si el calor específico del rodamiento es 0.474 J / g °C,
y deseamos que la temperatura de equilibrio sea de 21.19°C, ¿a qué temperatura
debe calentarse el rodamiento antes de depositarlo en el calorímetro? //
Pulse aquí.
👉Enunciado: Una bola de rodamiento de acero inoxidable de
30.14 g a 117.82 °C se colocará en un calorímetro de presión constante que
contiene 120.0 mL de agua a cierta temperatura. Si el calor específico del
rodamiento es 0.474 J / g ° C, y deseamos que la temperatura de equilibrio sea
de 21.19 °C, ¿a qué temperatura debe estar el agua antes de que se adicione el
rodamiento? // Pulse aquí.
👉Enunciado: Una
hoja de oro que pesa 10.0 g y una temperatura de 18.0 ° C se coloca plana sobre
una hoja de hierro que pesa 20.0 g y una temperatura de 55.6 ° C. ¿Cuál es la
temperatura final de los metales combinados? Suponga que no se pierde calor en
los alrededores. Asuma que el calor específico del oro es 0.129 J/g-°C y del
hierro es 0.444 J/g-°C //
Pulse aquí.
👉Enunciado: A una muestra de agua a 23.4 °C en un
calorímetro de presión constante de capacidad calorífica insignificante se le
agrega una pieza de aluminio de 12.1 g cuya temperatura es 81.7 ° C. Si la
temperatura final del agua es 24.9 ° C, calcule la masa del agua en el
calorímetro. Asuma que el calor específico del aluminio es
0.900 J/g-°C y del agua es 4.184 J/g-°C // Pulse aquí.
Para una reacción en agua
Al contrario de lo que podría esperarse,
las ecuaciones para la calorimetría de reacciones a presión constante son más
simples. En este caso el agua no es solo un cuerpo extra, es un solvente, lo
cual nos lleva al hecho de que podría usarse otro solvente, por ende,
definiremos esto para cualquier solvente (ii) y para el reactivo limitante (i).
👉Enunciado: Demuestre las ecuaciones para un calorímetro
de presión constante para calcular la capacidad calorífica de una reacción, o
la temperatura de equilibrio // Pulse aquí.
👉Enunciado: Se mezcló 1.00 x 102 mL de HCl
0.500 M con 1.00 x 102 mL de NaOH 0.500 M en un calorímetro de
presión constante de capacidad calorífica insignificante. La temperatura
inicial de las soluciones de HCl y NaOH fue la misma, 22.50 ° C, y la
temperatura final de la solución mezclada fue de 25.86 ° C. Calcule el cambio
de calor para la reacción de neutralización sobre una base molar NaOH (aq) +
HCl (aq) → NaCl (aq) + H2O (l) Suponga que las densidades y los
calores específicos de las soluciones son los mismos que para el agua (1.00 g /
mL y 4.184 J / g ° C, respectivamente) // Pulse aquí.
👉Enunciado: Se mezcla 4.00 x 102 mL de HNO3
0.600 M con 4.00 x 102 mL de Ba(OH)2 0.300 M en un
calorímetro de presión constante de capacidad calorífica insignificante. La
temperatura inicial de ambas soluciones es la misma a 18.46 °C. ¿Cuál es la
temperatura final de la solución? Asuma que la entalpía estándar de la reacción
es de -56.2 kJ/mol // Pulse aquí.
👉Enunciado: Se mezcla una cantidad de 200 mL de HCl 0.862
M con 200 mL de Ba(OH)2 0.431 M en un calorímetro de presión
constante de capacidad calorífica insignificante. La temperatura inicial de las
soluciones de HCl y Ba(OH)2 es la misma a 20.48 °C. Para el proceso
H+ (aq) + OH- (aq) → H2O (l) el calor de
neutralización es -56.2 kJ/mol. ¿Cuál es la temperatura final de la solución
mezclada? // Pulse aquí.




No hay comentarios:
Publicar un comentario