(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(La
ley de Henry) (Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
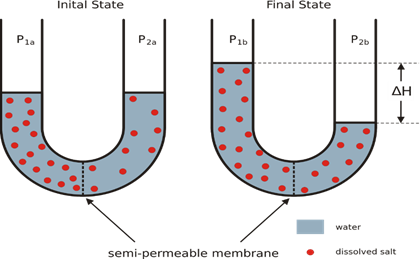
Ciertos materiales, incluyendo muchas membranas en sistemas biológicos y sustancias sintéticas como el celofán, son semipermeables. Cuando entran en contacto con una solución, estos materiales permiten que solo los iones o moléculas pequeñas (moléculas de agua, por ejemplo) pasen a través de su red de poros pequeños. Considere una situación en la que solo las moléculas de disolvente pueden pasar a través de una membrana semipermeable colocada entre dos soluciones de diferentes concentraciones. La velocidad a la que las moléculas de disolvente pasan de la solución menos concentrada (menor concentración de soluto, pero mayor concentración de disolvente) a la solución más concentrada (mayor concentración de soluto, pero menor concentración de disolvente) es mayor que la velocidad en la dirección opuesta. Por lo tanto, hay un movimiento neto de moléculas de solvente de la solución con una concentración de soluto más baja en la de una concentración de soluto más alta. En este proceso, llamado ósmosis, el movimiento neto del solvente siempre es hacia la solución con la concentración más baja de solvente (soluto más alto), como si las soluciones fueran impulsadas para alcanzar concentraciones iguales.
Figura 25. La presión osmótica. Un tubo U separa dos soluciones por medio de una
membrana permeable al solvente, pero no al soluto.
Dado que las sustancias siempre tienden al equilibrio, el
estado desequilibrado de las concentraciones genera una presión osmótica que
favorece la absorción de agua por parte de la solución concentrada, y aunque
los volúmenes se desigualen, la presión osmótica intentará igualar las
concentraciones, hasta el límite impuesto por la presión atmosférica, así
cuando la presión osmótica se iguala a la atmosférica, se alcanza el equilibrio
del sistema.
El modelado
matemático de la osmosis se realiza por medio de la fórmula de los gases
ideales, en la que se despeja la presión y obtendremos masa en gramos sobre
volumen, que se reemplaza por la concentración. La presión despejada solo se
iguala a la presión osmótica si multiplicamos a ambos lados por el factor de
Van't Hoff
Demostración
Iniciamos con la ley de los
gases ideales.
Despejamos la concentración
molar
Multiplicamos a ambos lados por
el factor de van’t Hoff
El producto de la presión por
el factor de van’t Hoff es la presión osmótica.
(36)
Miremos un ejemplo numérico.
La presión osmótica media de la sangre es de 7,7 atm a 25
° C. ¿Qué molaridad de la glucosa C6H12O6 será isotónica con la sangre?
Solución analítica: Despejamos
la concentración de la ecuación anterior.
Solución numérica:
Si dos soluciones de presión osmótica idénticas están separadas por una membrana semipermeable, no se producirá una ósmosis. Las dos soluciones son isotónicas una con respecto a la otra. Si una solución es de presión osmótica más baja, es hipotónica con respecto a la solución más concentrada. La solución más concentrada es hipertónica con respecto a la solución diluida. En términos más sencillos, la solución más concentrada absorbe agua de la menos concentrada en un intento de igualar la concentración por aumento de solvente.
Figura 26. Tono de una célula dependiendo de la
concentración externa de solutos. Una
célula isotónica mantiene su volumen, una célula hipotónica pierde agua y se
arruga, y una célula hipertónica absorbe agua y explota.
La ósmosis juega un papel importante en los sistemas vivos.
Las membranas de los glóbulos rojos, por ejemplo, son semipermeables. Colocar
un glóbulo rojo en una solución que sea hipertónica en relación con la solución
intracelular (la solución dentro de las células). Hace que el agua salga de la
célula Figura
26.
Esto hace que la célula se arrugue, un proceso llamado crenación. Colocar la célula en una solución
hipotónica en relación con el líquido intracelular hace que el agua se mueva
hacia la célula, lo que puede hacer que la célula se rompa, un proceso llamado lisis. Las personas que necesitan reemplazo de
líquidos o nutrientes corporales, pero que no pueden ser alimentadas por vía
oral, reciben soluciones mediante infusión intravenosa, que alimenta los
nutrientes directamente en las venas. Para prevenir la formación de crenaciones
o hemólisis de los glóbulos rojos, las soluciones intravenosas deben ser
isotónicas con los líquidos intracelulares de las células sanguíneas.




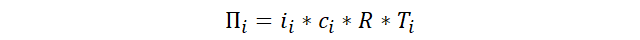




No hay comentarios:
Publicar un comentario