(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(La
ley de Henry) (Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
En las secciones anteriores hemos descrito cualitativamente como ocurre y por qué ocurre el proceso de solubilización. En esta sección nos enfocaremos en cuánto de un determinado soluto puede diluirse en una determinada cantidad de solvente bajo ciertas condiciones de temperatura. Nos enfocaremos principalmente en la solubilidad de solutos sólidos en el agua, mediante el instrumento denominado curva de Solubilidad.
Modelo general
La solubilidad puede modelarse como una verdadera ecuación
química:
(4)
El equilibrio de la solubilidad representa el punto crítico
en que una cantidad de solvente puede aguantar una cantidad de soluto acuoso,
la reacción es reversible, y por ende esa cantidad cambia dependiendo de las
condiciones del ambiente. Más allá de las consideraciones teóricas, la pregunta
es ¿cómo resolvemos un problema de solubilidades? Y antes que esa, debemos
plantearnos ¿en qué consiste un problema de equilibrio de solubilidades? Los
problemas de equilibrio de solubilidades se pueden diferenciar en las
siguientes acciones:
·
Identificar la saturación del sistema.
·
Identificar la masa máxima a las condiciones
dadas.
·
Identificar la masa faltante/sobrante.
De hecho, el modelo para resolver este problema será
semejante al que emplearemos para los problemas de reactivo limitante en
estequiometría. Para resolver esto, emplearemos la ecuación de avance de la
reacción para un reactivo y para un producto, que es el modelo matemático
general del equilibrio químico.
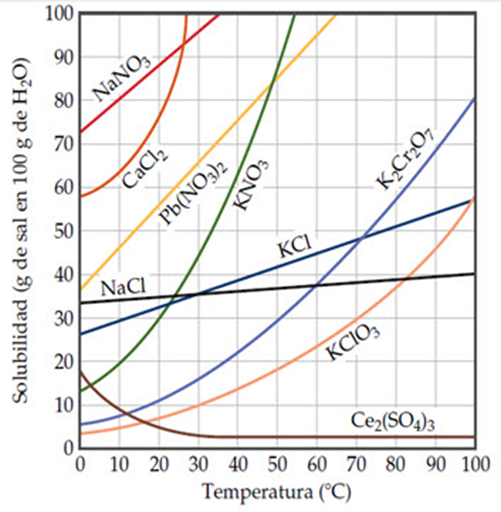
Figura 11. Curvas de solubilidad de varias sales, dependiendo de la temperatura a 100 g de solvente.
(5)
Demostración
En este caso asumiremos
arbitrariamente que el reactivo es el sólido y el producto es el acuoso y que
los coeficientes estequiométricos son iguales, al ser la misma sustancia.
La cantidad de sustancia acuosa
inicial es cero ya que tendremos un solvente puro al inicio.
Dependiendo de la cantidad de
sustancia sólida al final, determinaremos el índice de saturación de la
solución, y por ende, despejaremos dicho termino.
Finalmente definimos la
cantidad de sustancia acuosa, como la cantidad máxima que puede estar en estado
acuoso.
(6)
Este es el modelo generalizado de la solubilidad, donde se
dice que la cantidad de sustancia del cristalizado o precipitado ni es la diferencia entre
el agregado ni0
y el que ha sido absorbido por el solvente y queda en estado acuoso naq. Sin embargo, la
cantidad de sustancia que es absorbida en estado acuoso depende de la cantidad
de solvente, y de aquí en más la de nominaremos cantidad máxima.
Debido a que las tres sustancias en la ecuación (5)
son de la misma sustancia, podemos reemplazar la cantidad de sustancia a masa
sin ningún problema.
(7)
En este punto agregamos la notación T
para indicar que la masa máxima y la masa del solido en equilibrio dependen de
la temperatura del sistema.
La masa máxima mmax
es la masa final de una muestra tomada a partir de una solución estándar de
concentración constante, esta concentración estándar es el límite crítico a una
temperatura dada, y por ende se la denomina solubilidad y se le da su propio
símbolo si,T,
pero tenga en cuenta que este símbolo representa a una concentración.
El problema aquí es que si,T puede asumir
cualquiera de las unidades de concentración vistas, pero la más usada en este
contexto es una que no hemos visto, siendo masa de soluto entre masa de solvente:
(8)
Donde m*i,T
es la masa de soluto que se encuentra en
equilibrio de saturación con la cantidad estándar de solvente mii* que generalmente son 100 g de agua.
Estos valores estándar se dan como parte del texto de enunciado, en una tabla o
en una gráfica.
Ahora, el punto es que la masa máxima
dependiente de la temperatura mmax,T
que puede absorber un solvente mii está diluida en una
cantidad final de solvente que se relaciona con la misma solubilidad de la
solución estándar dependiente de la temperatura si,T.
Por lo que podemos
igualar ambas expresiones:
(9)
(10)
Y por lo anterior, podemos calcular la
masa máxima que puede absorber una cantidad arbitraria de solvente por medio de
los valores estándar a una temperatura determinada.
(11)
Con la definición de la masa máxima podemos reemplazar en (7).
(12)
Solución analítica: Aplicamos
la ecuación (12).
Solución numérica
A 70 °C.
Como
tenemos una masa de soluto sólido final de 5 g, la solución se encuentra
sobresaturada.
A 30 °C.
Como
la masa de soluto sólido final es de -5 g, esto implica que la solución está
insaturada y faltan 5 g para saturarla.
En caso de que el solvente esté dado en volumen, podemos
aproximar la respuesta asumiendo que la densidad de la solución es igual a la
densidad del agua, y por ende convertir directamente ml a g.
La solubilidad del nitrato de plata, a 18 °C, es de 211,6
g en 100 mL de agua.
a)
¿Cuántos gramos de nitrato de plata se pueden disolver como máximo en 400 mL de
agua a 18 °C?
b)
¿Cuánto nitrato hay que añadir a 1 L de agua para que se sature?
Solución analítica:
La solución del punto (a) se
obtiene con la ecuación (11).
Para la solución (b) aplicamos
la ecuación (12)., igualando la masa sólida a 0, que es la condición de saturación.
Solución numérica: aproximamos
la respuesta asumiendo 100ml=100gL 400 mL=400g; y 1 L = 1000 g.
Punto (a)
Punto (b), convierta
Solución analítica: Aplicamos
la ecuación (12).
Solución numérica: Tenga en
cuenta que el solvente estándar está en gramos y el solvente usado está en
mililitros, convertiremos implícitamente el volumen a masa, dado que la densidad
del agua es 1g/mol, solo es expresar 300 g en lugar de 300 ml.
Obtuvimos
50 g de soluto sólido, se confirma que es una solución sobresaturada (mezcla
heterogénea) y que se cristalizaron 50 g.
Solución analítica: ecuación (11).
Solución numérica: Convierta ml
a g:





















No hay comentarios:
Publicar un comentario