(Ciencias de Joseleg)
(Química) (Química cuantitativa) (Termoquímica)
(Ejercicios) (Introducción)
(Historia)
(Energía)
(Sistema,
alrededores y calor) (Primera
ley de la termodinámica) (Entalpía)
(Entalpía
de la reacción) (Capacidad
calorífica y calor específico) (Calorimetría
a volumen constante) (Calorimetría
a presión constante) (Ley
de Hess) (Entalpía
de formación) (Calor
de solución y disolución) (Termoquímica
de los alimentos) (Termoquímica
de los combustibles) (Energía
del futuro) (Referencias
bibliográficas)
A diferencia de la materia, la energía no tiene masa y no puede mantenerse
en nuestras manos “de hecho si alguien pudiera
manifestar su ki “a la Dragon Ball” lo que aparecería en las manos no es
energía, sino plasma, una forma de materia gaseosa ionizada con alta energía”.
A pesar de estos dilemas conceptuales, los efectos derivados de los
intercambios energéticos pueden observarse y medirse. La energía es la capacidad de hacer trabajo o transferir
calor. Antes de que podamos hacer uso de esta definición, debemos
comprender los conceptos de trabajo y calor. El trabajo es la energía utilizada
para hacer que un objeto se mueva contra una fuerza, y el calor es la energía
utilizada para aumentar la temperatura de un objeto. Antes de examinar estas
definiciones más de cerca, consideremos primero las formas en que la materia
puede poseer energía y cómo esa energía puede transferirse de una pieza de
materia a otra.
Energía cinética y potencial
Los objetos, ya sean pelotas de béisbol o moléculas, pueden poseer energía
cinética, la energía del movimiento. La magnitud de la energía cinética, Ek, de un objeto
depende de su masa, m y velocidad, u, no usaremos la v en
el contexto químico debido a que se usa para el coeficiente estequiométrico:
Por lo tanto, la energía cinética de un objeto aumenta a medida que aumenta
su velocidad. Por ejemplo, un automóvil que se mueve a 55 millas por hora (mi /
h) tiene mayor energía cinética que a 25 millas / h. Para una velocidad dada,
la energía cinética aumenta al aumentar la masa. Por lo tanto, un camión grande
que viaja a 55 mi / h tiene mayor energía cinética que un sedán pequeño que
viaja a la misma velocidad porque el camión tiene la mayor masa.
En química, estamos interesados en la energía cinética de los átomos y las
moléculas. Aunque son demasiado pequeñas para ser vistas, estas partículas
tienen masa y están en movimiento y, por lo tanto, poseen energía cinética.
Todos los demás tipos de energía, la energía almacenada en un resorte
estirado, en un peso sostenido sobre su cabeza o en un enlace químico, por
ejemplo, son energía potencial. Un objeto tiene energía potencial en virtud de
su posición con respecto a otros objetos. La energía potencial es, en esencia,
la energía "almacenada" que surge de las atracciones y repulsiones
que un objeto experimenta en relación con otros objetos.
Estamos familiarizados con muchos casos en los que la energía potencial se convierte en energía cinética. Por ejemplo, piense en un ciclista en la cima de una colina Figura 3‑1). Debido a la fuerza de gravedad atractiva, la energía potencial del ciclista y su bicicleta es mayor en la cima de la colina que en la parte inferior. Como resultado, la bicicleta se mueve fácilmente cuesta abajo con mayor velocidad. Al hacerlo, la energía potencial se convierte en energía cinética. La energía potencial disminuye a medida que la bicicleta rueda cuesta abajo, pero su energía cinética aumenta a medida que aumenta la velocidad (Ecuación 3.1). Este ejemplo ilustra que las formas de energía son interconvertibles.
Figura 3‑1.
Energía potencial y energía cinética. La energía potencial inicialmente
almacenada en la bicicleta inmóvil y el ciclista en la cima de la colina se
convierte en energía cinética a medida que la bicicleta se mueve cuesta abajo y
pierde energía potencial.
Las fuerzas gravitacionales juegan un papel insignificante en la forma en
que los átomos y las moléculas interactúan entre sí. Las fuerzas que surgen de
las cargas eléctricas son más importantes cuando se trata de átomos y
moléculas. Una de las formas más importantes de energía potencial en química es
la energía potencial electrostática, Ei,el, que surge de las
interacciones entre partículas cargadas. Esta energía es proporcional a las
cargas eléctricas en los dos objetos que interactúan, Q1 y Q2, e inversamente
proporcional a la distancia, ∆x, que los separa.
En esta ecuación, k es la constante de proporcionalidad, 8.99×109
J m / C2, que relaciona las unidades de energía con las unidades de
carga eléctrica y su distancia de separación. (C) es el culombio, una unidad de
carga eléctrica, y (J) es el julio, una unidad de energía que discutiremos
pronto. A nivel molecular, las cargas eléctricas Q1 y Q2 son típicamente del
orden de magnitud de la carga del electrón.
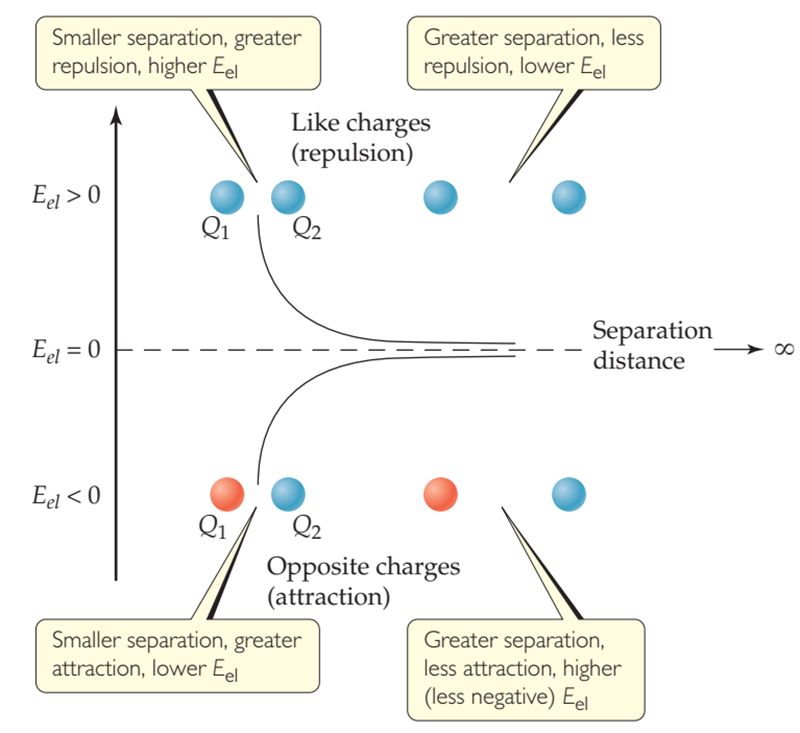
La ecuación 3.2 muestra que la energía potencial electrostática llega a cero cuando ∆x se vuelve infinita. Por lo tanto, el cero de energía potencial electrostática se define como la separación infinita de las partículas cargadas.
Figura 3‑2.
Energía potencial electrostática. A distancias de separación finitas para dos
partículas cargadas, Eel es positiva para cargas similares y
negativa para cargas opuestas. A medida que las partículas se alejan más, su
energía potencial electrostática se acerca a cero.
La Figura 3‑2 ilustra cómo se
comporta Eel a medida que cambia la distancia entre dos
cargas. Cuando Q1 y Q2
tienen el mismo signo (por ejemplo, ambos positivos), las dos partículas
cargadas se repelen entre sí, y una fuerza repulsiva las separa. En este caso,
la anguila es positiva, y la energía potencial disminuye a medida que las
partículas se separan más. Cuando Q1 y Q2 tienen signos
opuestos, las partículas se atraen entre sí, y una fuerza atractiva las atrae
entre sí. En este caso, Eel sea negativa y la energía
potencial aumenta (se vuelve menos negativa) a medida que las partículas se
separan.
Uno de nuestros objetivos en química es relacionar los cambios de energía
observados en el mundo macroscópico con la energía cinética o potencial de las
sustancias a nivel molecular. Muchas sustancias, como los combustibles, por
ejemplo, liberan energía cuando reaccionan. La energía química de un
combustible se debe a la energía potencial almacenada en las disposiciones de
sus átomos.
Cuando se quema un combustible, esta energía química se convierte en
energía térmica, energía asociada con la temperatura. El aumento de la energía
térmica surge del aumento del movimiento molecular y, por lo tanto, del aumento
de la energía cinética.
Unidades de energía
La unidad SI para la energía es el joule (pronunciado "jool"), J,
en honor de James Joule (1818-1889), un científico británico que investigó el
trabajo y el calor: 1 J = 1 kg m2/s2. Debido a que un
joule no es una gran cantidad de energía, a menudo usamos kilojoules (kJ) para
discutir las energías asociadas con las reacciones químicas.
Tradicionalmente, los cambios de energía que acompañan a las reacciones
químicas se han expresado en calorías, una unidad no perteneciente al SI que
todavía se usa ampliamente en química, biología y bioquímica. Una caloría (cal)
se definió originalmente como la cantidad de energía requerida para elevar la
temperatura de 1 g de agua de 14.5 a 15.5 ° C.
Una unidad de energía relacionada utilizada en nutrición es la Caloría
nutricional (tenga en cuenta la C mayúscula).







No hay comentarios:
Publicar un comentario