👉Enunciado: Hallar las funciones que permitan describir un calorímetro en términos de una reacción de combustión y la masa o cantidad de sustancia del reactivo limitante. Tenga en cuenta el efecto del cambio de cantidad de gas.
|| Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
👉Solución: Iniciamos con la expresión de cambio de energía interna con respecto a
calor y trabajo.
Digamos que si no conocemos como cambia el
volumen y la presión, pero si conocemos como cambia su equivalente en términos
de cantidad de sustancia clave y una ecuación química balanceada.
Y que el cambio de energía interna sea igual
al inverso de la entalpía.
La pregunta sería ¿Cómo carajos calculamos el
calor? Por el momento asumiremos a priori que corresponderá a al propio calor
de reacción, pero sin cambio de signo ya que no hay una transferencia.
Y reemplazamos.
También sabemos que la
entalpía para una cantidad de sustancia arbitraria es igual al avance de la
reacción por la entalpía estándar.
El avance de la
reacción se puede reemplazar por un radio de De-Donder para una reacción no
reversible. En este caso, para el reactivo limitante que es el reactivo clave
de la combustión.
Por ende, la entalpía
estándar de la reacción, es decir, para una mol de reacciones, es:
Sin embargo, también podemos querer calcular
la entalpía asociada a una sustancia, tendiendo en cuenta que:
Por ende:
Si deseamos hacer el cálculo directo con los
datos de la estandarización reemplazamos la capacidad calorífica estándar.
Donde e es la sustancia de estandarización.
👉Otros
enunciados: Halle las fórmulas para un calorímetro de bomba o de volumen constante
simplificadas, Hallar las fórmulas para un calorímetro de bomba o de volumen constante
simplificadas,
👉Temas: química, química general, Termoquímica, joseleg, calor, capacidad
calorífica, calor específico, calorímetro de presión constante

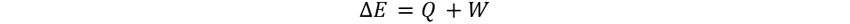







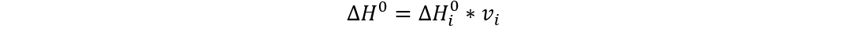



No hay comentarios:
Publicar un comentario