(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(La
ley de Henry) (Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
La presión de vapor es un fenómeno que ocurre como la interacción de dos fases, una fase líquida y una fase gaseosa separadas por una tensión superficial que actúa como frontera o “membrana semipermeable”. El sistema nominalmente se define como cerrado, y las partículas que fluyen entre la fase líquida y la fase gaseosa son de solvente.
Figura 14. Presión de vapor. (Izquierda) En un equilibrio simple tenemos que la
velocidad de flujo entre las dos fases se iguala. (Derecha) Una solución tiene
una presión de vapor diferente de la de un solvente o un soluto por separado.
La presión de vapor o presión de vapor en equilibrio se define como la presión ejercida por un vapor
en equilibrio termodinámico con sus fases condensadas (sólido o líquido) a una
temperatura dada en un sistema cerrado. La presión de vapor de equilibrio es
una indicación de la velocidad de evaporación de un líquido. Se relaciona con
la tendencia de las partículas a escapar del líquido (o un sólido). Una
sustancia con una alta presión de vapor a temperaturas normales a menudo se
conoce como volátil.
La vaporización de un elemento o compuesto es una transición
de fase de la fase líquida al vapor. Hay dos tipos de vaporización: evaporación
y ebullición.
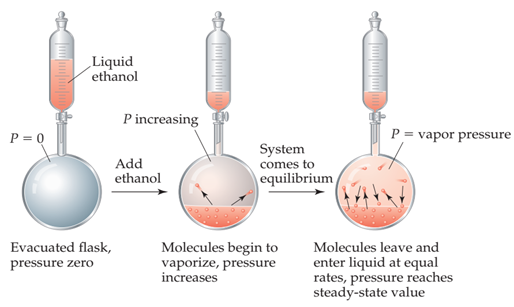
Figura 15. Medición de la presión de vapor. En el montaje de la derecha el balón está en el vacío,
por lo que no hay gases en su interior, y tenemos una jeringa con etanol
líquido. Al adicional etanol, parte de su sustancia líquida cambia a gas a una
temperatura inferior de la de ebullición hasta que se alcanza el equilibrio en
el tercer momento.
La evaporación es una transición de fase de la fase líquida
al vapor (un estado de la sustancia por debajo de la temperatura crítica y la presión crítica)
que se produce a temperaturas por debajo de la temperatura de ebullición a una
presión determinada. La evaporación usualmente ocurre en la superficie, donde
las capas más externas se desligan de la tensión superficial y escapan a la
atmósfera. La evaporación puede ocurrir cuando la presión parcial de vapor de
una sustancia es menor que la presión de vapor de equilibrio.
La ebullición es una transición de fase de la fase líquida a
la fase gaseosa que se produce a la temperatura de ebullición o por encima de
ella. La ebullición, a diferencia de la evaporación, ocurre debajo de la
superficie. La ebullición se produce cuando la presión de vapor de equilibrio
de la sustancia es mayor o igual que la presión ambiental. Por este motivo, el
punto de ebullición varía con la presión del ambiente. La evaporación es un
fenómeno de la superficie, mientras que la ebullición es un fenómeno masivo.
Aunque una sustancia no ebulla con un aumento leve de la
temperatura, por debajo de su punto de ebullición, sus moléculas de todas
formas vibrarán más, lo cual aumentará su grado de evaporación, esta es la
causa de que las destilaciones jamás puedan obtener fracciones realmente puras,
aun cuando las dos sustancias a separar tengan puntos de ebullición diferentes,
la sustancia de menor punto de ebullición puede evaporar fracciones de sí.
Miremos cómo funciona la volatilidad con el siguiente
ejemplo: La presión de vapor de un líquido es la
presión que ejerce el vapor de ese líquido a una temperatura determinada. A
20°C se tienen iguales cantidades de cuatro líquidos P,Q,R,S cada uno en un
recipiente cerrado conectado a un manómetro como se muestra en el siguiente
dibujo. Organice los frascos de mayor a menor volatilidad.
Figura 16. Medición de la
volatilidad en un sistema de presión constante, en este caso, aunque
técnicamente la presiones la misma, aquella sustancia más volátil será la que
expanda el volumen de su microatmósfera a un mayor volumen.
Las presiones del
vapor de cada una de las cuatro sustancias expanden el volumen de su atmósfera
interna hasta que se igualan a la presión atmosférica externa, así que
técnicamente las presiones en los cuatro frascos son de 1 atm. Sin embargo, si
hiciéramos este experimento con un contenedor de atmósferas rígido podríamos
decir que aquellas atmosferas que se expanden más tendrían mayor presión de
vapor, por ende, el orden de presiones de vapor es: PQ>PS>PP>PR.
Las moléculas pueden escapar de la superficie de un líquido
a la fase gaseosa por evaporación. Supongamos que colocamos una cantidad de
etanol CH3CH2OH en un recipiente cerrado y
evacuado, como en la Figura
15.
El etanol comienza a evaporarse rápidamente. Como resultado, aumenta la presión
ejercida por el vapor en el espacio por encima del líquido. Al cabo de poco
tiempo, la presión del vapor alcanza un valor constante, al que llamamos presión de vapor.
En cualquier momento, algunas de las moléculas de etanol en
la superficie del líquido poseen suficiente energía cinética para superar las
fuerzas atractivas de sus vecinos y, por lo tanto, escapar a la fase gaseosa. A
cualquier temperatura particular, el movimiento de las moléculas de la fase
líquida a la fase gaseosa continúa continuamente. Sin embargo, a medida que
aumenta la cantidad de moléculas en fase gaseosa, aumenta la probabilidad de
que una molécula en la fase gaseosa golpee la superficie del líquido y sea
recapturada por el líquido, como se muestra en el matraz de la derecha en la Figura
15.
Finalmente, la velocidad a la que las moléculas regresan al líquido es igual a
la velocidad a la que escapan. El número de moléculas en la fase gaseosa
alcanza un valor constante y la presión ejercida por el vapor se vuelve
constante.
La condición en la que dos procesos opuestos ocurren
simultáneamente a tasas iguales se llama equilibrio dinámico (o simplemente
equilibrio). El equilibrio químico, es un tipo de equilibrio dinámico en el que
los procesos opuestos son reacciones químicas. Un líquido y su vapor están en
equilibrio dinámico cuando la evaporación y la condensación se producen a
velocidades iguales. Puede parecer que no ocurre nada en el equilibrio porque
no hay un cambio neto en el sistema. De hecho, sin embargo, muchas cosas
suceden cuando las moléculas pasan continuamente del estado líquido al estado
de gas y del estado de gas al estado líquido. La presión de vapor de un líquido
es la presión ejercida por su vapor cuando el líquido y el vapor están en
equilibrio dinámico.
Cuando ocurre la vaporización en un recipiente abierto, como
cuando el agua se evapora de un charco, el vapor se separa del líquido. Poco,
si lo hay, se recaptura en la superficie del líquido. El equilibrio nunca se
produce, ya que el volumen del contenedor es todo el condenado Planeta Tierra,
y el vapor continúa formándose hasta que el líquido se evapora a sequedad. Las
sustancias con alta presión de vapor (como la gasolina) se evaporan más
rápidamente que las sustancias con baja presión de vapor (como el aceite de
motor). Se dice que los líquidos que se evaporan fácilmente son volátiles.
El agua caliente se evapora más rápidamente que el agua fría
porque la presión
de vapor aumenta al aumentar la temperatura. Para ver por qué
esta afirmación es cierta, comenzamos con el hecho de que las moléculas de un
líquido se mueven a varias velocidades, La Figura
17
muestra la distribución
de las energías cinéticas de las moléculas en la superficie
de un líquido a dos
temperaturas. A medida que aumenta la temperatura, las moléculas se mueven con
más energía y más de ellas pueden liberarse de sus vecinos y entrar en la fase
gaseosa, lo que aumenta la presión de vapor.
Figura 17. Energía cinética mínima para volatilización. Las moléculas en vibración no vibran con la misma
intensidad, sino que lo hacen con promedios y extremos, los extremos son las
moléculas que vibran tan poco que son sólidos microscópicos o las que lo hacen
tan fuerte que escapan del líquido espontáneamente. El aumento de la
temperatura provoca un desplazamiento de la vibración hacia la derecha,
aumentando el número de moléculas que logran la vibración suficiente como para
escapar de la tensión superficial.
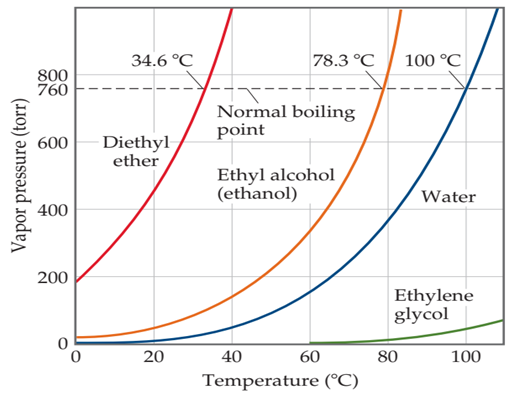
Figura 18. Presión de vapor con respecto a la
temperatura de varias sustancias volátiles. El aumento de la presión de vapor de líquidos puros con
respecto a la temperatura, cuando la presión alcanza los 760 torr los líquidos ebulle
a 1 atm de presión ambiental.
El punto de ebullición de un líquido es la temperatura a la
cual su presión de vapor es igual a la presión externa actuando sobre la
superficie del líquido.
(22)
Cuando la presión de vapor alcanza la presión de la
atmósfera, el líquido inicia el cambio de fase a gas.
A esta temperatura, la energía térmica de las moléculas es
lo suficientemente grande como para que las moléculas en el interior del líquido se liberen de sus vecinos
y entren en la fase gaseosa, todas en masa. Como resultado, se
forman burbujas de vapor dentro del líquido. El punto de ebullición aumenta a
medida que aumenta la presión externa, es decir, entre más comprimido esté el
líquido, más difícil es escaparse de él. El punto de ebullición de un líquido a
1 atm (760 torr) de presión se denomina punto de ebullición normal. En la Figura
18
vemos que el punto de ebullición normal del agua es de 100 ° C.
El tiempo requerido para cocinar los alimentos en agua
hirviendo depende de la temperatura del agua. En un recipiente abierto, esa
temperatura es siempre de 100 °C como máximo, pero es posible hervir a
temperaturas más altas. Las ollas a presión “u ollas pitadoras” funcionan
permitiendo que el vapor se escape solo cuando supera una presión
predeterminada, que es superior a la de la atmósfera; Este aumento de presión
provoca que el agua se mantenga líquida por encima de los 100°C, lo que permite
que los alimentos se calienten y se cocinen más rápidamente.
Estime el punto
de ebullición del dietileter a una presión de 0,8 atmósferas, empleando los
datos de la Figura 5. Solución analítica: Debemos convertir de
atmósferas a torricellis, multiplicando por 760, el resultado es 608
torricellis.
Posteriormente debemos dibujar una recta a 608 torr, luego
buscamos el intersecto con la curva del dietil éter y dibujar una segunda recta
que baje a la temperatura. La escala de la gráfica no colabora mucho, pero
podemos estimar que la temperatura debe estar cercana a los 30°C La respuesta exacta es 27°C.







No hay comentarios:
Publicar un comentario