(Ciencias de Joseleg) (Química) (Química cuantitativa) (Estequiometría
analítica) (Ejercicios) (Introducción) (Historia) (Estequiometría
clásica) (Nueva
estequiometría) (Reactivo
limitante y reactivo en exceso) (Titulaciones
básicas) (Pureza,
rendimiento y eficiencia) (Las
gravimetrías) (Estequiometría
de gases) (Análisis
de composición) (Análisis
de cenizas) (Referencias
bibliográficas)
El análisis gravimétrico es una técnica analítica basada en la medición de la masa de algún producto para determinar la relación en masa de un reactivo, y aunque la más famosa es la gravimetría de halosales, la técnica funciona con cualesquiera reacciones en la que generemos un producto insoluble al cual le medimos la masa.
Figura 12. Precipitado de cloruro de plata en un análisis
gravimétrico simple.
Las
halosales son sales formadas por cationes y halógenos, principalmente cloro y
bromo, para medir una halosal soluble se emplea nitrato de plata para generar
un precipitado gravimétricamente analizable, por ejemplo, el cloruro de sodio
es una halosal soluble típica de cloro. La reacción global es de doble
desplazamiento:
34.
El
nitrato de plata soluble y por ende invisible en el tubo de ensayo, reacciona con
una sal halógena, en este caso cloruro de sodio, el cual también es soluble o
acuoso e invisible en un tubo de ensayo aparte. Cuando mezclamos el contenido
de los dos tubos de ensayo se genera una reacción de doble desplazamiento. El
ion nitrato de una carga negativa se va con el sodio de una positiva para
formar nitrato de sodio acuoso y, por lo tanto, invisible, sin embargo, en el
segundo desplazamiento el ion plata de una carga positiva se va con el anión
cloruro de una negativa formando la sal plata y halógeno, cloruro de plata,
esta sal es molecular aun cuando esta mezclada en agua, además es visible, pues
al insolubilizarse los dos iones aparecen como de la nada formando un
precipitado. La clave del análisis gravimétrico es medir la masa del
precipitado de halogenuro de plata.
Calcular el porcentaje en masa del halógeno en la halosal.
El punto problemático es que desconocemos la identidad de la
halosal presente.
35.
Todos los halógenos en compuestos binarios tienen un poder
de enlace de 1, por lo que la cantidad de halógenos depende solo del metal
asociado. Pero, no necesitamos conocer la estequiometría real de la situación,
en este caso podemos modelar todo como dos reacciones de descomposición.
36.
37.
De aquí en adelante llamaremos a (MXa) como (r) o reactivo
clave, y (AgX) domo (p) o producto clave.
38.
39.
Como nuestro objetivo es conocer el porcentaje en masa del
halógeno, asumiendo que conocemos la masa experimental de la muestra, en
realidad lo que deseamos saber es la masa del halógeno. Aquí nos podemos valer
con que la masa del halógeno es igual en la semirreacción del halógeno y la
semirreacción de la plata. Por ende, modelaremos para el cloruro de plata.
Deducción
En la sal de plata el subíndice
del halógeno siempre es 1
Que usando la tercera ley de
Avogadro puede pasar a moles.
Y usando la masa molar.
Despejamos la masa del halógeno
Dividimos a ambos lados entre la
masa de la halosal.
Siendo el cociente (mX/mi)
la fracción de masas de X.
Y al multiplicar por 100 y
cambiar las identidades de (r) por el reactivo clave que es la halosal
desconocida (MXa) y (p) por el haluro de plata correspondiente (AgX):
40.
Con lo cual hemos obtenido una expresión simplificada para
hacer estequiometría sin términos estequiométricos.
Ejemplo
19. Una muestra
de 0,7077 g de un compuesto iónico que contiene iones cloruro y un metal
desconocido de valencia +1 (XCl) se disuelve en agua y se trata con un exceso
de AgNO3. Si se forman 1,3602 g de precipitado de AgCl, ¿cuál es el
porcentaje en masa de Cl en el compuesto original? YouTube.
Aplicamos la ecuación.
La masa molar del cloro es 35.45
g/mol, y la del cloruro de plata es 143.3 g/mol








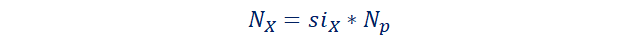










No hay comentarios:
Publicar un comentario