👉 𝑬𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐: De los siguientes calores de combustión,
CH3OH(l) + 3/2O2(g) → CO2(g) + 2H2O(l) ∆H°rxn
= -726.4 kJ/mol;
C(grafito) + O2(g) → CO2(g)
∆H°rxn = -393.5 kJ/mol;
H2(g) + 1/2O2(g) → H2O(l)
∆H°rxn = -285.8 kJ/mol;
calcule la
entalpía de formación del metanol (CH3OH) a partir de sus elementos:
C(grafito ) + 2H2(g) + ½O2(g)
→ CH3OH(l)
|| Enlace a YouTube || Mas ejercicios resueltos
termoquímica || Mas ejercicios de otros
capítulos || Curso de termoquímica
|| ¡Si te gustó, suscríbete!
||
👉 𝑫𝒆𝒎𝒐𝒔𝒕𝒓𝒂𝒄𝒊𝒐𝒏𝒆𝒔 𝒚/𝒐 𝒄𝒐𝒏𝒄𝒆𝒑𝒕𝒐𝒔 𝒕𝒆ó𝒓𝒊𝒄𝒐𝒔:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-ley-hess.html
👉 𝑺𝒐𝒍𝒖𝒄𝒊ó𝒏: En su orden llamaré a cada
una de las reacciones como 1, 2 y 3.
🔎
Reacción
1: Necesito a CH3OH(l) del lado de los productos, por lo que multiplico
por -1 su entalpía estándar.
🔎
Reacción
2: Necesito a C(grafito) sin modificaciones.
🔎
Reacción
3: Necesito el doble de H2(g),
por lo que multiplico por 2 su entalpía estándar.
Calculemos entonces la entalpía con la ley de Hess.
Tenga en cuenta que en este caso la entalpía estándar
de la reacción es igual a la están entalpía estándar de formación de la
sustancia producto, ya que en la ecuación neta final sólo se está produciendo una
molécula de producto, pero si se estuvieran produciendo una cantidad diferente de
producto, deberíamos emplear una modificación de la ley de Hess.
👉 𝑶𝒕𝒓𝒐𝒔 𝒆𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐𝒔: CH3OH(l) + 3/2O2(g) → CO2(g) + 2H2O(l) ∆H°rxn
= -726.4 kJ/mol, C(grafito) + O2(g) → CO2(g) ∆H°rxn = -393.5
kJ/mol, H2(g) + 1/2O2(g) → H2O(l) ∆H°rxn = -285.8
kJ/mol, calcule la entalpía de formación del metanol (CH3OH) a
partir de sus elementos, C(grafito ) + 2H2(g) + ½O2(g) → CH3OH(l)
👉 𝑻𝒆𝒎𝒂𝒔: química, química general, Termoquímica,
joseleg, calor, entalpía, entalpía de la reacción, entalpía estándar de la
reacción, entalpía específica para una sustancia en la reacción, avance de la
reacción, ley de hess ejemplos, ley de hess ejercicios, ley de hess ejercicios
resueltos, ley de hess definición, ejercicios ley de Hess, entalpia termodinámica,
ejercicios de entalpía resueltos, ejercicios de entalpia

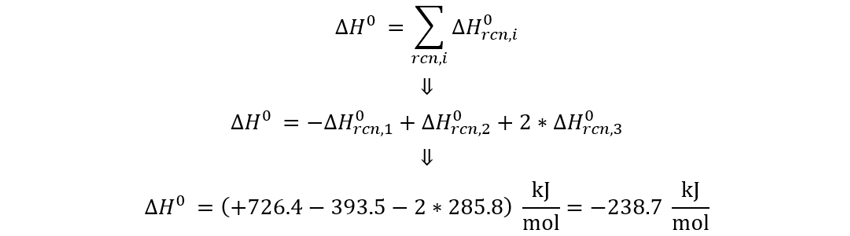

No hay comentarios:
Publicar un comentario