(Ciencias de Joseleg) (Química) (Química cuantitativa) (Disoluciones
y propiedades coligativas) (Ejercicios) (Introducción) (Generalidades) (Mezclas
homogéneas y heterogéneas) (Mezclas
homogéneas o disoluciones) (Tipos
de disoluciones) (Introducción
a las unidades de concentración) (Porcentaje
en masa) (Notación
partes por) (Porcentaje
volumen a volumen) (Porcentaje
masa a volumen) (Concentración
molar) (Concentración
normal) (Peso
equivalente y factor equivalente) (Concentración
molal) (Fracción
molar) (Conversiones
entre unidades de concentración líquidas)
(Unidades
de concentración en gases) (Conversiones
de unidades de concentración gaseosas)
(Cambios
de concentración subcríticos) (Alícuotas,
destilaciones y mezclas) (Referencias
bibliográficas)
Una mezcla es una combinación física de dos o más sustancias puras en la que cada sustancia conserva su propia identidad química, aun cuando, la mezcla como un todo pueda poseer propiedades emergentes provenientes de la interacción de los componentes de la mezcla.
Los componentes de una mezcla conservan su identidad porque
se mezclan físicamente en lugar de combinarse químicamente. Considere la
posibilidad de una mezcla de pequeños cristales de sal de roca y arena
ordinaria. Mezclar estas dos sustancias no cambia la sal ni la arena de ninguna
manera. Las partículas de sal más grandes e incoloras se distinguen fácilmente
de los gránulos de arena más pequeños, de color gris claro. Una característica
de cualquier mezcla es que sus componentes se pueden separar utilizando métodos
físicos. En nuestra mezcla de sal y arena, los cristales de sal más grandes
podrían ser, aunque muy tediosamente, "manualmente" de la arena. Un
método de separación algo más fácil sería disolver la sal en agua, lo que
dejaría atrás la arena no disuelta. La sal podría recuperarse por evaporación
del agua. Una mezcla de azufre sólido (polvo amarillo) y ferrita de hierro. Se
puede usar un imán para separar los componentes de esta mezcla. Otra
característica de una mezcla es la composición variable. Se pueden hacer
numerosas mezclas diferentes de sal y arena, con composiciones que varían desde
una mezcla de arena ligeramente salada hasta una mezcla de sal ligeramente
arenosa, variando las cantidades de los dos componentes.
Figura 3.
Mezclas heterogéneas. (Izquierda) Una
mezcla heterogénea entre sólidos. (Derecha) Una mezcla heterogénea entre
líquidos. Tenga en cuenta, para líquidos y gases, que el más denso cae y el
menos denso flota.
Las mezclas se subclasifican como heterogéneas u homogéneas.
Esta subclasificación se basa en el reconocimiento visual de los componentes de
la mezcla. Una mezcla heterogénea es una mezcla que contiene fases (partes)
visiblemente diferentes, cada una de las cuales tiene propiedades diferentes.
Una apariencia no uniforme es una característica de todas las mezclas
heterogéneas. Los ejemplos incluyen galletas con chispas de chocolate y muffins
de arándanos. Las mezclas heterogéneas que ocurren naturalmente incluyen rocas,
suelos y madera.
Figura 4.
Capa de Smog en Bogotá DC, Colombia.
Las mezclas heterogéneas pueden ser sólido a sólido; líquido
a líquido; sólido a líquido; gas a líquido; pero nunca gas a gas. Las mezclas
de sólido en sólido se caracterizan por carecer de suficiente energía para
separarse espontáneamente, mientras que las demás mezclas heterogéneas si se
pueden separarse espontáneamente en fases, separadas por una frontera
claramente visible. Una fase es
cualquier parte de una muestra que tiene una composición y propiedades
uniformes. Por definición, una sustancia pura o una mezcla homogénea consiste
en una sola fase. Una mezcla heterogénea consiste en dos o más fases. Cuando el
aceite y el agua se combinan, no se mezclan uniformemente, sino que forman dos
capas separadas. Cada una de las capas se llama fase.
En el ejemplo de la sopa de verduras, una fase sería la sopa
líquida en sí misma. Esta fase tiene vitaminas, minerales y otros componentes
disueltos en el agua. Esta fase sería homogénea. Las zanahorias, los guisantes,
el maíz u otras verduras representan otras fases de la sopa. Las diversas
verduras no se mezclan uniformemente en la sopa, sino que se distribuyen al
azar. Hay una gran cantidad de mezclas heterogéneas a nuestro alrededor. El
suelo está compuesto de una variedad de sustancias y, a menudo, tiene una
composición diferente dependiendo de la muestra tomada. Una pala puede producir
tierra y pasto, mientras que la siguiente pala podría contener una lombriz de
tierra.
Mezclas homogéneas
Las mezclas
homogéneas son justo el opuesto de las heterogéneas. Sí, en las mezclas
heterogéneas podemos visualizar fácilmente los componentes que se están
mezclando, en una mezcla homogénea la característica es que sólo queda
aparentemente una sustancia, el solvente, mientras que la otra u otras
sustancias aparentan desaparecer, es decir, los solutos. En este orden de
ideas, podemos afirmar que, Las mezclas homogéneas son un sinónimo de
soluciones químicas o disoluciones.
Cómo no podemos
emplear nuestros ojos para poder evaluar la mezcla homogénea, empleamos otra
serie de características, o propiedades emergentes de las soluciones: color
homogéneo, olor, sabor, textura, viscosidad o conductividad eléctrica.
Una pareja de soluto y solvente
pueden potencialmente formar tanto mezclas homogéneas como mezclas
heterogéneas, y la diferencia dependerá de la cantidad de soluto, la cantidad
de solvente y condiciones fisicoquímicas que los rodean como la presión, la
temperatura o la atracción gravitacional.
Cambios de temperatura y su efecto en el
agua
El cambio de estado puede afectar a la densidad vía el
cambio de volumen, por lo general a mayor temperatura mayor volumen, pero eso
no es siempre cierto, el hielo que es agua sólida expande su volumen
disminuyendo su densidad lo que le permite flotar en el agua, y por ende
formando una mezcla heterogénea, eso protege a los seres vivos en los polos ya
que el hielo refleja el calor interno de regreso al agua evitando que todo un
lago o rio se congele, protegiendo así a los seres vivos que habitan al
interior de la capa de hielo.
Figura 5.
Densidad del hielo y el agua y la vida
en los polos. Los osos polares
no podrían cazar, si no fuera por el hecho de que el agua se congela de arriba
“el hielo formado se desplaza inmediatamente a la superficie” hacia abajo hasta
un límite, pues una vez formada la lámina blanca, esta impide que el calor
interno escape, permitiendo la vida debajo.
Ahora, si nos concentramos en el agua líquida, esta se
expande con la temperatura, lo cual afecta las concentraciones, pues a mayor
volumen del solvente, la concentración disminuye aun cuando las cantidades de
sustancia sean las mismas, las unidades de concentración volumétricas como la
molaridad y la normalidad son sensibles a estos cambios, por lo que los
ejemplos que se dan en los textos se plantean a una temperatura estándar de
25ºC mientras que unidades de masa como la molalidad o el porcentaje en masa no
son sensibles al cambio en el volumen del solvente.
Finalmente, el cambio a gas siempre disminuye la densidad,
ya que los gases no tienen límite en su expansión excepto las fronteras de su
contenedor.
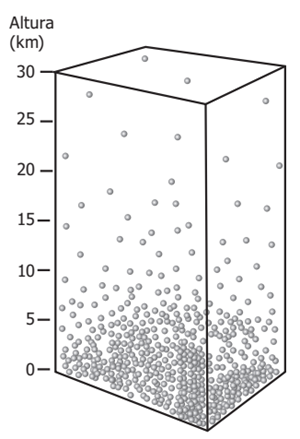
Las partículas de un gas se ven afectadas por la gravedad de manera significativa solo si la altura del contenedor es lo bastante grande.
Figura 6.
Aunque normalmente se nos dice
que los gases se expanden homogéneamente en un contenedor, esto no es cierto
para contenedores de alturas elevadas frente a una fuente de gravedad que atrae
las partículas, la atmosfera por lo tanto es heterogénea en su distribución,
siendo más densa en el nivel del mar.
En estos casos, la densidad es mayor al nivel del mar que en
la cúpula debido a que la gravedad provoca una caída de las partículas del gas,
esto indica que los gases ejercen más presión en la base que en la cima,
cuestión que se denomina, presión atmosférica.
Mezclas homogéneas y
heterogéneas en términos de una ecuación química
Como se
mencionó anteriormente, podemos emplear el lenguaje de las ecuaciones químicas
para poder crear un modelo de cómo ocurre una mezcla homogénea.
Para este
propósito, deberemos introducir los conceptos de subíndices para estado de la
materia o estado de solución: (s) Para sólidos puros, (l) Para líquidos puros,
(g) para gases puros o en mezclas, (aq) Para disoluciones en agua.
El lector
debe tener en cuenta que existen muchos tipos de solventes, aparte del agua. Y
que algunas sustancias jamás podrán mezclarse en agua como los alcanos o los
aceites. Sin embargo, por el momento sólo nos preocuparemos por modelar matemáticamente
un soluto que se disuelve en agua. En este caso, el agua va a funcionar sólo
como un catalizador.
(1)
La ecuación química no es demasiado compleja y establece que las moléculas del soluto i-ésimo Que se encuentran en su sólido cristalino puro al ser mezcladas en agua, se transforman en moléculas disueltas en agua o acuosas. Uno de los aspectos más importantes que será crucial posteriormente, es el hecho de que los números estequiométricos son iguales, A menos que el sólido cristalino esté en una forma de reactivo en exceso. En ese caso, el agua contenida es insuficiente para convertir todo el sólido cristalino en moléculas acuosas. Y, por lo tanto, va a quedar una cierta cantidad de reactivo en exceso todavía sólida, creando una mezcla heterogénea.






No hay comentarios:
Publicar un comentario