(Ciencias de Joseleg) (Química) (Química cuantitativa) (Estequiometría
analítica) (Ejercicios) (Introducción) (Historia) (Estequiometría
clásica) (Nueva
estequiometría) (Reactivo
limitante y reactivo en exceso) (Titulaciones
básicas) (Pureza,
rendimiento y eficiencia) (Las
gravimetrías) (Estequiometría
de gases) (Análisis
de composición) (Análisis
de cenizas) (Referencias
bibliográficas)
¿Cuánto obtengo a partir de una cantidad conocida de producto?, ¿Cuánto tengo que invertir en reactivos para obtener una cantidad deseada de producto? estas preguntas literalmente dieron origen a la teoría atómica, y de hecho ambas historias están superpuestas (lo mismo que algunos de sus ejercicios), por lo que esto es solo un resumen, para ina discusión mas extensa, puede buscar el capítulo del átomo químico.
Con el auge de la física newtoniana, los científicos se
dieron cuenta que la naturaleza no estaba plagada de actos caóticos o caprichos
de seres metafísicos, o como diría Carl Sagan, nuestro mundo natural posee patrones que
pueden ser descritos matemáticamente y expresados en fórmulas
matemáticas a las que llamamos leyes naturales.
Aunque los físicos fueron los primeros en encontrar
relaciones matemáticas simples a los fenómenos naturales, con el tiempo los
químicos comenzaron a indagar en esta idea, y es que debemos recordar que, para
estos tiempos, alrededor de los siglos XVI y XVII la química aún se encontraba
sumergida en las ideas alquimistas, los cuales aún usaban explicaciones
metafísicas, caprichos espirituales, para explicar muchos de los cambios en la
sustancia de las cosas.
En este contexto aparecen las leyes ponderales, de las
cuales solo citaremos dos, la ley de la conservación de la masa que ya vinos en
el capítulo anterior y la ley de proporciones definidas.
1.
Que se puede visualizar como que el cociente de masas en una
reacción química es una constante. La clave es que esta constancia aplica a
cualquier reacción química, aunque históricamente solo se enfocaron en las
reacciones de descomposición.
Con el radio de masas fue posible fijar la masa de alguna
sustancia común a un valor constante, y luego ver la masa que le era
equivalente para diversas reacciones químicas. Durante la realización de las
tablas, fue evidente que la relación de proporcionalidad matemática entre la
incógnita y el dato era lineal, en lenguaje moderno diríamos que, la relación
entre la masa de la incógnita y la masa del dato depende de una constante de
proporcionalidad que llamaremos radio de masas (ζ):
2.
La ley de Proust expresada de este modo funciona igual que
las leyes de los gases, y al dividirla entre si misma, pero para las masas
iniciales correspondientes, la constante se cancelará.
3.
Lo cual nos permitirá calcular la masa de una sustancia con
las masas iniciales y la masa de otra sustancia.
Observe que la ecuación anterior plantearía que la relación
de pesos equivalentes es experimental, y no requiere en ningún momento la
hipótesis de átomos, moléculas, cantidades de sustancia, entre otras porque en
ese tiempo esos conceptos no habían sido desarrollados.
El primer químico de quien tengamos constancia en encontrarse con la ley de proporciones recíprocas y sistematizarla en tablas de pesos estandarizados arbitrarios fue Jeremias Benjamin Richter (1762-1807). Como químico, Richter es responsable de algunas de las primeras determinaciones de las cantidades en peso en las que los ácidos saturan bases y viceversa, y de llegar a la concepción de que esas cantidades eran constantes cuando se las ponderaba en una proporción fraccionaria. Impulsado por sus resultados, Richter fue llevado a la conclusión de que la química es una rama de las matemáticas aplicadas. En realidad, escribió en el prefacio a The Principles of Stoichiometry, o The Art of Measuring Chemical Elements (vols. 1-3, 1792-94) (Partington, 1948): "Todas las ciencias relacionadas con las magnitudes pertenecen a las matemáticas. La razón por la que se hace tan poco progreso en esta rama, es que los químicos rara vez se ocupan de las matemáticas y los matemáticos no sienten ningún llamado a hacer conquistas para el arte de la medición en el campo de la química ".
Figura
2. Jeremias Benjamin Richter. (10 de marzo de 1762 - 14 de abril de 1807) fue un
químico alemán. Nació en Hirschberg en Silesia, se convirtió en funcionario
minero en Breslau en 1794, y en 1800 fue nombrado asesor del departamento de
minas y químico de la fábrica de porcelana real en Berlín, donde murió. Es
conocido por introducir el término estequiometría.
De este modo, pudo rastrear la ley de proporciones
recíprocas o equivalentes en 1791, así, por ejemplo: Se necesitaron 615 partes en peso de magnesia
(MgO), por ejemplo, para neutralizar 1000 partes en peso de ácido sulfúrico, en
este y otros casos Richter empleó al ácido sulfúrico como unidad de comparación
igual a 1000 partes arbitrarias.
Debemos notar que, la relación anterior es errónea, si
usamos gramos, la relación real para 1000 gramos de ácido sulfúrico puro es de
411 gramos de MgO. Estas diferencias pudieron ser ocasionadas por varias
razones a saber: impurezas de los reactivos, y errores experimentales debidos a
las tecnologías aplicadas en ese momento. Una vez se cuenta con los pesos
estandarizados, es posible hacer un cálculo de lápiz y papel que predice el
comportamiento de experimentos futuros como ¿Cuál es la masa de MgO requerida
para neutralizar 2000 g de H2SO4?
Existen muchas formas de llegar a la respuesta, por ejemplo,
racionalizando que estamos tratando con el doble de una de las sustancias, por
lo que la otra debe ser de 822 gramos. La segunda forma que es la más popular
es empleando factores de conversión:
5.
Es muy probable que alguna de las dos formas anteriores
fueran las que empleó Richter, ya que él tenía poca confianza en las
capacidades algebraicas de sus colegas químicos. Aunque, es posible calcularlo
con la fórmula (4.)
6.
A partir de sus datos, Ernst Gottfried Fischer (1754-1831)
calculó en 1802 la primera tabla de equivalentes químicos, tomando el ácido
sulfúrico como estándar con la cifra 1000. Richter define su nueva ciencia de
la estequiometria, como "la ciencia de medir las proporciones cuantitativas o relaciones de
masa en las que los elementos químicos se encadenan unos a otros"
(DeLanda, 2015).
El nivel de "matemáticas químicas" utilizado por
Richter para explicar los principios de la estequiometría no era ciertamente
congruente con el nivel sofisticado demostrado por matemáticos y físicos
anteriores (Descartes, Newton, Leibniz, Euler) y aquellos contemporáneos de
Richter (Lagrange, Laplace), es como comparar matemáticas de proporciones
equivalentes (fracciones simples) con
sacar un operador laplaciano, es literalmente medir la distancia en años de aprendizaje
desde aritmética de primaria a cálculo universitario y aun así eran
consideradas "oscuras y torpes" por los químicos contemporáneos, por
lo que sus ideas fueron inicialmente desapercibidas (Michałowska-Kaczmarczyk, Asuero, & Michałowski, 2015).
Sin embargo, el propio Ricther también tenía una mala
opinión de sus colegas químicos en cuanto a habilidades matemáticas se refiere,
porque en el volumen 1 del “Anfangsgrunde
der Stochiometrie”, dio, entre otras, explicaciones de los signos +
y =; de hecho en la época todos los estudiantes de ciencias naturales con
talento matemático terminaban siendo físicos, y los que las odiaban, terminaban
en química o historia natural, por lo que no es de extrañar una resistencia a
la irrupción de las matemáticas en la química (Michałowska-Kaczmarczyk et al., 2015).
Años más tarde otros químicos como G.E. Fischer de Berlín
recalculó los datos de Richter sobre el ácido sulfúrico puro (que Richter no
calculó) y los combinó en una nueva tabla de pesos equivalentes. Esta tabla se
incluyó en la traducción alemana del "Essai d´une
statistique chimique" de Claude Louis Berthollet de 1803 y
Thomas Thompson la incorporó a la edición de 1807 de su System
of Chemistry (Michałowska-Kaczmarczyk et al., 2015).
La aceptación de la ley de las proporciones recíprocas permitió
la elaboración de tablas de pesos equivalentes de elementos, o de gramos
equivalentes “de donde viene la expresión equivalente-gramo”. Estos pesos
equivalentes fueron ampliamente utilizados por los químicos en el siglo XIX,
pues a diferencia de los átomos, los pesos equivalentes si podían medirse
fácilmente, eran un concepto real o empírico, que no necesitaba imaginarse
cosas invisibles como los átomos, y esta noción empírica de la química
prevaleció por mucho tiempo (Padilla & Furio-Mas, 2008).
Teniendo en cuenta que las observaciones de Richter llevaron
al desarrollo del equivalentismo, ahora veremos que también impactaron en el
atomismo y su posterior crisis a principios del siglo XX. Cuando me refiero a
que la teoría atómica fue una teoría en crisis, no es que yo sea equivalentista
no antiatomista, el hecho es que hay que mirarlo desde una perspectiva
histórica, pues, aunque hoy el átomo sea la teoría ganadora, no siempre fue
así, especialmente a principios del siglo XX, pues el átomo, junto con la
teoría de la evolución fueron vilipendiados por científicos de la época. En
otras palabras, tanto las teorías de la evolución y del átomo muestran que una
teoría en crisis no necesariamente es reemplazada por un paradigma diferente,
sino más bien se va transformando en una serie de modelos que conservan la idea
de fondo.
El concepto de estequiometría fue crucial para el posterior
desarrollo de la teoría atómica por Dalton. Las leyes de proporción definida de
Proust, que datan de 1806, y la ley de proporciones múltiples de Dalton,
formulada en 1808, fueron las primeras observaciones cuantitativas realizadas
sobre el comportamiento de un gran grupo de compuestos, considerados como
sustancias.
La ley de proporción definida de Proust establece que en la
síntesis de un compuesto las proporciones en peso de las sustancias que lo
generan son siempre iguales, es básicamente la aplicación de la ley de Richter,
pero para el caso concreto de la síntesis de compuestos. Por ejemplo, si en un
experimento se necesitaban 8 g de oxígeno gaseoso para consumir 1 g de
hidrógeno gaseoso, si en un segundo experimento empleaba 4 g de hidrógeno
gaseoso entonces se necesitaba una proporción 4 veces más grande de oxígeno
para consumirlo completamente.
La ley de proporciones múltiples es semejante, pero señala que, dependiendo de las condiciones experimentales, un mismo par de elementos podía generar diferentes compuestos cada uno con su propia relación de proporción de masas definida. Así, por ejemplo, 1 gramo de nitrógeno puede reaccionar con diferentes cantidades fijas de oxígeno para generar diferentes óxidos de nitrógeno.
Figura 3. En cada renglón hay una proporción definida que da
identidad al óxido generado, pero cuando se examinan todas las posibles
reacciones, te das cuenta de que existen varios compuestos posibles con los
mismos elementos.
Ambas leyes fueron concebidas desde la perspectiva inductiva
(mediante experimentos) en los cuales se señalaba que las proporciones podían
redondearse fácilmente a números enteros
pequeños, valores que Dalton afirmaba eran prueba de la existencia
de los átomos, como explicación última de dichas proporciones enteras.
Sin embargo, no todos estuvieron de acuerdo con Proust y
Dalton, Claude Louis Berthollet se enfrentó a una larga batalla con Proust,
sobre la validez de la ley de proporciones definidas, el debate fue tan arduo y
perseverante que la cuestión no fue zanjada sino hasta que Jöns Jacob Berzelius
la confirmó en 1811.
Proust acabó prevaleciendo en su definición de compuestos
con proporciones en masa de números enteros pequeños que hoy llamamos estequiométricos
o daltónidos, los más frecuentes, aunque en el siglo XX se descubrieron algunas
sustancias que se desviaban de esta regla y para el siglo XX fueron denominados
bertólidos o no estequiométricos.
Con esto Dalton propuso que las sustancias estaban
constituidas por entidades elementales y discretas llamadas átomos, pero falló
en representar apropiadamente las proporciones de combinación de varias
sustancias como el agua, y los gases elementales como hidrógeno y oxígeno.
La razón de esto es que la relación en peso que Dalton midió
es lo que se conoce como peso equivalente, el cual no hace evidente la relación
estequiométrica verdadera entre las sustancias, sin embargo, el mayor problema
de todos es que experimentalmente lo más fácil era llegar a estos pesos
equivalentes, a menos que encontraras una reacción sobre aparecieran las
verdaderas relaciones de peso entre los elementos.
John Dalton empleó las leyes ponderales para argumentar que
las reacciones se fundamentaban en moléculas que reaccionaban en eventos de
reacción. Para su desgracia, y por ignorar la ley de volúmenes de combinación
de Gay-Lussac, modeló inapropiadamente la molécula de agua, lo cual llevó a una
confusión entre los químicos del siglo XIX que duró casi 60 años.
A la postre estas confusiones y desarrollo de conceptos generaron
que el peso de los elementos este dado en diferentes escalas.
La masa de una partícula
La primera es que uno esperaría que los átomos tengan masas
absolutas en gramos, lo que llamaremos la masa de la partícula (mp), que
dependiendo de la partícula en cuestión recibe el nombre de masa atómica y masa
molecular. Para evitar la proliferación de símbolos redundantes (mp) lo
usaremos para masas atómicas o moleculares, que distinguiremos por medio de
subíndices, siendo (I) para átomos e (i) para moléculas.
El peso equivalente
Fue la escala que dalton confusió con la masa relativa,
cuestión que se extendió por varias décadas del siglo XIX. En realidad, lo que
Dalton calculó fue el peso equivalente relativo al hidrógeno. En el capítulo de
unidades de concentración veremos como definir el peso equivalente con lenguaje
moderno.
La masa relativa
La masa relativa (Ar) puede pertenecer a un átomo o
una molécula, y es el valor que aparece en la tabla periódica. La masa relativa
es el promedio de masas relativas de los isótopos de ese elemento en la corteza
terrestre, y sus unidades son adimensionales. Originalmente las masas relativas
se calculaban con respecto al hidrógeno, pero en la actualidad se hace con
respecto al inverso de la constante de Avogadro.
La masa molar
Es igual a la masa relativa pero multiplicada por 1 g/mol. Y
por ende es la masa en gramos en un mol de sustancia.
Sin embargo, como mencionamos anteriormente, Dalton y
compañía no llegaron directamente a estos valores, sino a los pesos
equivalentes relativos al hidrógeno, el dilema para los químicos es que no
sabían cómo elegir entre los diferentes pesos equivalentes, el verdadero peso
atómico, pues un mismo elemento podía generar más de un solo peso equivalente.
El hecho de que algunos elementos tuvieran más de un peso
equivalente dependiendo de las condiciones de reacción no detuvo a los químicos
de proponer tablas estandarizadas como la de uno de los primeros libros de
texto llamado “Problemas químicos y reacciones que
acompañan a los elementos químicos de Stöckhardt” escrito por Josiah
Parsons Cooke (Cooke, 1857).
Tabla 1. Tabla de símbolos y pesos atómicos en el libro de texto
de Cooke de 1857, tres años antes de que Cannizaro popularizara una técnica
para hallar los pesos atómicos a los que estamos acostumbrados.
Los verdaderos pesos atómicos “que en este contexto se
refiere a la masa relativa” de cada elemento no pudieron obtenerse sino hasta
que Cannizaro decidió tomarse en serio las hipótesis de Avogadro en 1858 y
emplearlas para generar un método para calcular tanto las fórmulas moleculares
como para determinar las masas relativas.
En la actualidad podemos resumir el método de Cannizaro como
despejar la masa molar de la ley de los gases ideales, y convertir masa sobre
volumen en la densidad específica de la sustancia.
7.
8.
9.
10.
Solo se necesita estandarizar la presión y la temperatura a
valores constantes, de 1 atm de presión y una temperatura de 0°C. Al hacer
esto, la ecuación anterior se convierte en.
11.
Donde (Vm) actualmente recibe el nombre de
volumen molar, pero por muchos años recibió el nombre de molécula-gramo. Dado
que el peso en gramos de cada elemento era constante a esos 22,4 L, este pasó a
ser el conocido como el peso del elemento.
Observe que en ningún punto de este proceso se hacen medidas
con átomos o moléculas, sin embargo, los atomistas tomaron estos pesos de
elemento corregidos para los gases diatómicos como los pesos atómicos.
Desafortunadamente, el artículo de Cannizzaro se publicó
inicialmente solo en italiano y tuvo poco impacto inmediato.
El verdadero avance se produjo con un congreso internacional
de productos químicos celebrado en la ciudad alemana de Karlsruhe en septiembre
de 1860. Charles A Wurtz y August von Kekulé quienes organizaron el encuentro
que pretendía acabar con las profundas
diferencias de palabras y símbolos que dañan la comunicación y la discusión,
que son fuentes esenciales del progreso científico.
El congreso no solucionó nada de fondo con respecto a la
teoría atómica, pero si popularizó los pesos atómicos de Cannizzaro, que
Mendeleev y otros emplearon para construir las primeras tablas periódicas (Thyssen, 2010).
Hacia principios del siglo XX, una gran cantidad de científicos
aceptaron el atomismo como una explicación satisfactoria de los experimentos
sobre la naturaleza de la materia. Sin embargo, había dos voces poderosas en la
vanguardia de los antiatomistas: Wilhelm Ostwald en Leipzig y Ernst Mach en
Viena. El primero, un devoto de la termodinámica, detestaba las doctrinas mecánicas
y dudaba de la realidad de los átomos, considerándolos como meros artificios
mentales. La opinión de Mach estaba en línea con la de Ostwald, aunque quizás
algo más extrema al rechazar los átomos. Entre los aliados de Ostwald y Mach
había científicos como Pierre Duhem y George Helm (Morowitz, 1991).
El principal defensor de la hipótesis atómica fue Ludwig
Boltzmann. En 1906, el gran físico se quitó la vida. Se ha sugerido que su
estado de depresión se debió en parte al fracaso de muchos científicos,
incluidos Ostwald y Mach, en aceptar la visión cinética molecular de la materia
que él había defendido. En cualquier caso, esta cuestión de la atomicidad era
un asunto serio para la comunidad científica.
Jean Perrin (1870-1942) fue educado en la Ecole Normale Superieure y siguió las
opiniones de su mentor, Marcel Brillouin, un firme defensor de Boltzmann y
oponente de Ostwald y Mach. De 1906 a 1909, Perrin llevó a cabo una serie
extraordinaria de observaciones sobre suspensiones de partículas lo
suficientemente pequeñas como para experimentar un movimiento browniano. El
movimiento browniano es el movimiento aleatorio que se observa en las partículas
que se hallan en un medio fluido (líquido o gas), como resultado de choques
contra las moléculas de dicho fluido.
Utilizando la mecánica estadística de Boltzmann y los
resultados teóricos sobre el movimiento browniano de Einstein y Roman
Smoluchowski, Perrin pudo, con solo un microscopio y un cronómetro, llegar a
valores de la constante de Boltzmann de varias formas diferentes. De este parámetro
fue capaz de derivar el número de Avogadro, la enumeración crucial de partículas
por mol necesaria para establecer la atomicidad (Perrin, 1911).
En 1913, Perrin reunió todo su trabajo sobre teoría atómica
en el libro Les Atomes. Se enumeran
16 determinaciones diferentes del número de Avogadro, muchas de las cuales había
realizado personalmente. La obra fue una obra maestra retórica que convenció a
casi todos incluyendo a Ostwald, pero no a Mach, de la validez de la hipótesis
atómica.
El trabajo de Perrín pasó por muchas ediciones y
traducciones, una versión en inglés apareció en 1920. En 1926, Perrin recibió
el Premio Nobel de Física. Para 1926, el mensaje de Perrin-Boltzmann había
tenido tanto éxito que nadie dudaba de la hipótesis atómica. El notable libro
que lo había reunido todo quedó sin leer. Los textos de química y física ahora
comienzan afirmando que toda la materia está compuesta de átomos. La prosa
suena a doxología: alaba los átomos de los que fluye toda la materia. Los
profesores han dejado de informar a los estudiantes sobre cómo se validó la hipótesis
atómica. Incluso han renunciado a informarse y el nombre de Perrin fue
expulsado de la gloria de los libros de texto. Uno de los libros científicos verdaderamente
grandiosos del siglo siglo XX acumula polvo en los estantes de las bibliotecas especializadas.
Para los años 20 del siglo XX los modelos atómicos se hicieron cuánticos y
nucleares, y las hipótesis científicas en la siguiente década se transformaron
en armas de guerra, demostrando la pavorosa realidad del átomo en el campo de
batalla.
Así, los químicos hicieron un uso extensivo de los átomos y modelos moleculares, mientras negaban su existencia real o afirmaban que los átomos eran ficciones útiles, abstracciones platónicas como los números. Incluso en el siglo XX y después de los experimentos de Perrin, algunos químicos que conocían la estructura electrónica de los átomos y presenciaron la desintegración radiactiva de los átomos



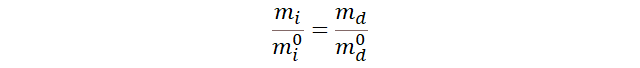












No hay comentarios:
Publicar un comentario