(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(La
ley de Henry) (Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
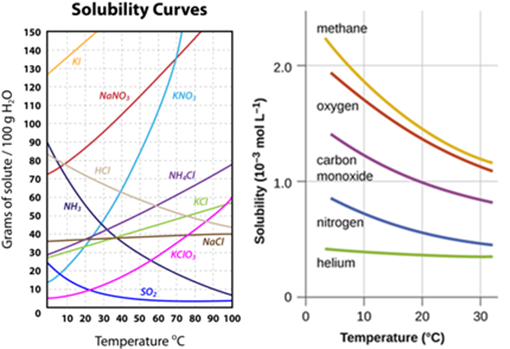
La solubilidad de la mayoría de los solutos sólidos, sean estos iónicos o moleculares, es mayor a medida que aumenta la temperatura, lo que significa que las soluciones normalmente pueden contener más soluto disuelto a mayor temperatura. Algunas sustancias muestran pocos cambios en la solubilidad a temperaturas más altas, y algunas son menos solubles al aumentar la temperatura. Por ejemplo, cuando agregas azúcar al té helado, puede formarse algo de azúcar sin disolver en el fondo del vaso. Pero si agrega azúcar al té caliente, se necesitan muchas cucharaditas de azúcar antes de que aparezca azúcar precipitado. El té caliente disuelve más azúcar que el té frío porque la solubilidad del azúcar es mucho mayor a una temperatura más alta.
Figura 13. Efecto de la temperatura en la solubilidad de
sólidos iónicos y gases. (Izquierda)
Las curvas de solubilidad representan las relaciones entre la solubilidad y la
temperatura de varios solutos sólidos comunes. (Derecha) Curvas de solubilidad
de un gas, por lo general la solubilidad disminuye con el aumento de
temperatura.
Cuando una solución
saturada se enfría cuidadosamente, se convierte en una solución sobresaturada
no cristalizada porque contiene más soluto de lo que permite la solubilidad,
pero sin cristalización aparente. Dicha solución es inestable y si la solución
se agita o si se añade un cristal de soluto, el exceso de soluto se
recristalizará para generar una mezcla heterogénea. Los solutos iónicos
solubles generalmente aumentan la solubilidad con la temperatura, pero existen
excepciones a esta regla general.
Por el contrario,
la solubilidad de un gas en el agua disminuye a medida que aumenta. A
temperaturas más altas, más moléculas de gas tienen la energía para escapar de
la solución. Quizás has observado las burbujas que escapan de un refresco
gaseoso frío mientras que calienta. A altas temperaturas, las botellas que
contienen soluciones carbonatadas pueden estallar a medida que más moléculas de
gas abandonan la solución e incrementan la presión del gas dentro de la
botella. Los biólogos han encontrado que el aumento de las temperaturas en los
ríos y lagos hacen que la cantidad de oxígeno disuelto disminuya hasta que el
agua caliente ya no pueda mantener una comunidad biológica. Las plantas
generadoras de electricidad deben tener sus propios estanques para usar con sus
torres de enfriamiento para disminuir la amenaza de contaminación térmica en
las vías navegables circundantes.
La solubilidad de
un gas es directamente proporcional a la cantidad parcial de este gas que
empuja la superficie del líquido, a mayor presión, mayor gas será disuelto en
el líquido. Esto se conoce como la ley de Henry.
(15)
Donde ci es la concentración del gas i-ésimo en la
fase líquida, Pi es la presión parcial del gas i-ésimo en la
fase atmosférica, y kH es una constante de proporcionalidad que dependerá del tipo de gas.
Entonces, esto es realmente una simple relación entre la cantidad de gas que se
disuelve en el líquido y la presión parcial del gas sobre la solución líquida.
La constante en esa ecuación también se ve afectada por otros tres factores. El
primero es la temperatura. Las constantes de la Ley de Henry son una función de las temperaturas. Si dejamos afuera
un vaso de agua del grifo durante mucho tiempo, las burbujas se forman a medida
que el agua se calienta a temperatura ambiente porque el aire disuelto en el
agua es en realidad más soluble cuando el agua está más fría. También depende
de qué gas se está disolviendo y qué disolvente o líquido se está utilizando.
La fórmula de la
ley de Henry, al igual que la de la estequiometria básica, se encuentra imbuida
en la ley general de los gases ideales en estado estático. Esto se debe
precisamente a la condición subyacente de solución ideal, en la que una
solución ideal posee las mismas propiedades que una mezcla de gases.
Deducción
Iniciamos con la ley de los gases ideales
para temperatura constante.
Combinamos las condiciones
constantes en una sola.
Pasamos volumen a dividir, para
obtener la concentración molar de un gas.
Convertimos a concentraciones.
Despejamos la concentración, y
el inverso de la constante 1 pasa a llamarse constante de Henry.
(16)
(17)
Con base a la
deducción anterior podemos afirmar que la constante de Henry debería obedecer
a:
(18)
La ecuación
anterior es la que nos explica analíticamente porqué la solubilidad del gas
disminuye con el aumento de temperatura. Dado que la solubilidad se da en
unidades de concentración, a menor temperatura, el efecto de la presión será
más alto y por consiguiente la concentración o solubilidad aumenta, pero a
mayor temperatura pasa lo inverso, el efecto de la presión disminuye y la
concentración será menor. El término (1/(R T)) se ajusta a una temperatura
estándar, por lo que se convierte en una nueva constante, la constante de
Henry.
Deducción
Realizar
el análisis dimensional para la constante de Henry.
Adicionalmente podemos plantear un valor hipotético para
dicha ley reemplazando (X) por 0,08206 y (Y) una temperatura, por ejemplo 298
K, que se usa en lugar de 273 K cuando se estandarizan soluciones líquidas. El
valor debería ser 0,041 mol atm-1 L-1
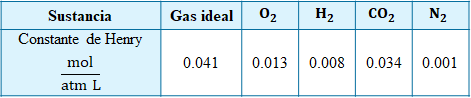
Sin embargo, a diferencia de un gas, dado que estamos hablando de volúmenes líquidos, hay desviaciones del comportamiento ideal que dependen del tipo de sustancia, así que la constante de Henry no es tan fácil como sacar el inverso de R T, hay que medirla experimentalmente para cada sustancia real (Tabla 3).
Tabla 3. Valores
experimentales de la constante de Henry, así como el valor ideal.
Lo importante aquí
es que, aunque las desviaciones del comportamiento ideal son notorias, el
análisis dimensional es correcto, y, por ende, es posible deducir la ley de
Henry para soluciones líquidas a partir de la ley de los gases ideales, aunque
se trata de un modelo para gases.
Al igual que sucede
con los gases ideales, la ley de Henry tiene dos formas, la de estado estático
que vimos en las secciones anteriores, y la de estado dinámico, que se obtiene
igual que con los gases ideales, dividir la ley definida para el momento final,
entre la misma ley definida para el momento inicial.
Deducción
Dividimos la ley estática
definida para el momento final, entre la misma ecuación definida para el momento
inicial.
Cancelamos las constantes, con
lo que obtenemos la forma dinámica.
(19)
Tenga en cuenta que
la forma dinámica de la ley de Henry tiene un a propiedad particular, siempre y
cuando las unidades de concentración sean iguales, estas se cancelan, y, por
ende, esta aceptará cualquier unidad de concentración, no solo la molar.
Ejemplo. La
solubilidad de cierto gas en agua es 0,745 g/L a presión estándar. ¿Cuál es su
solubilidad cuando la presión sobre la solución se eleva a 4,50 atm?
Solución analítica: Despejamos
la concentración final, que asumimos como la solubilidad de la ecuación 19
Solución numérica: La presión
estándar es 1 atm; y como se mencionó anteriormente, podemos operar aun cuando
la concentración dada no esté en unidades mol/L.
Cualitativamente
esperamos que la solubilidad de un gas aumente cuando aumenta la presión, el
resultado indica que la solubilidad aumentó de manera directa al valor de la
presión, por lo que conceptualmente el resultado tiene sentido dimensional.
Una característica
interesante de la ley de Henry radica en que los cocientes de varias unidades
de concentración son equivalentes.
Sacamos la ecuación 167, 172 de las conversiones de
unidades de concentración para gases.
Deducción
Dividimos la ecuación entre sí
misma, pero para el momento inicial.
La masa molar del soluto es
constante entre ambos momentos. El radio γ0/γ puede asumirme como 1
para soluciones ideales, por lo tanto:
(20)
Sacamos la ecuación 177 de las conversiones de unidades
de concentración para gases.
Deducción
Dividimos la ecuación entre sí
misma, pero para el momento inicial.
Nuevamente, la masa molar es
una constante.
(21)
El
nitrógeno en la sangre y el buceo
La Ley de Henry
explica por qué bucear con aire comprimido es peligroso; el nitrógeno
constituye el 78 %del aire. Por lo tanto, si nos sumergimos con aire comprimido
por un tiempo, el nitrógeno del tanque comienza a disolverse significativamente
en nuestra sangre bajo el aumento de la presión del agua, nuestros pulmones no
detonan debido a la presión del agua que evita su expansión. Sin embargo,
volver a la superficie elimina rápidamente esa presión; cuando esto sucede muy
rápido se forman pequeñas burbujas de nitrógeno en los pequeños vasos sanguíneos,
debido a la disminución de su solubilidad, lo que literalmente los hace
micro-explotar como pequeños globos en los tejidos capilares, en otras
palabras, el tejido pulmonar es destruido. Para evitar la muerte, si esto
ocurre, un buceador necesita llegar rápidamente a un hospital y ser resguardado
en una cámara hiperbárica que aumenta la presión nuevamente para que se
disuelvan las burbujas, y luego disminuya la presión lentamente para que el
nitrógeno escape por la respiración sin problemas.
Efecto del flujo en una corriente de agua
La
solubilidad de un gas también depende de la tensión superficial del agua, cando
el agua está en calma se genera una barrera en la superficie que impide un
flujo de gases hacia el interior del cuerpo de agua, pero cuando el agua está
agitada, su superficie permite el ingreso de grandes cantidades de aire. La Ley
de Henry nos dice que si ponemos agua pura en un frasco, el nitrógeno y el
oxígeno del aire se disolverán en el agua en proporción a sus presiones parciales.
Esto es importante para lagos, arroyos y otros reservorios de agua.
Los
peces y otras criaturas que viven en estos cuerpos de agua necesitan ciertos
niveles de oxígeno y dióxido de carbono para sobrevivir. A medida que el agua
se mueve y entra en contacto constante con el aire sobre la superficie, se
mantiene un nivel de oxígeno superior al que habría si esta quieta, lo que
permite que los peces sobrevivan. Sin embargo, en el océano, donde las
profundidades del agua pueden estar a kilometros, solo el agua cerca de la
superficie estará en contacto con el aire, mientras que el agua más abajo
tendrá poco oxígeno disuelto y podrá soportar muy poca vida acuática. En una
pecera, tenemos que usar un burbujeador para forzar suficiente oxígeno para
disolverse en el agua para que ciertos tipos de peces tengan suficiente oxígeno
para sobrevivir. En el mundo natural, los peces no necesitan burbujeantes, pues
los movimientos naturales de ciertos cuerpos de agua permiten una mayor
concentración del gas disuelto que lo que cabria esperarse por la ley de Henry
únicamente.
La broma de la soda
Cuando
se almacena agua con gas en una lata a una presión superior a la de la
atmósfera, que fuerza a que el gas fluya hacia el líquido alcanzando un
equilibrio. Este equilibrio puede alterarse en favor del líquido disminuyendo
la temperatura y agitándola. Con estos tres actos habrá una cantidad alta de
gas disuelto en el líquido. Si la botella se abre rápidamente, la presión
disminuye abruptamente, la solubilidad del gas disminuye, y por ende gran
cantidad pasa a fase gaseosa que buscará escapar del líquido. Esto no es
problemático si hay pocas moléculas de gas, pero si hay bastantes, se genera el
efecto de estampida, las burbujas de gas empujarán a las moléculas del líquido
con ellas, aumentando el volumen del líquido, lo cual genera un derrame.





















No hay comentarios:
Publicar un comentario