(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(La
ley de Henry) (Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
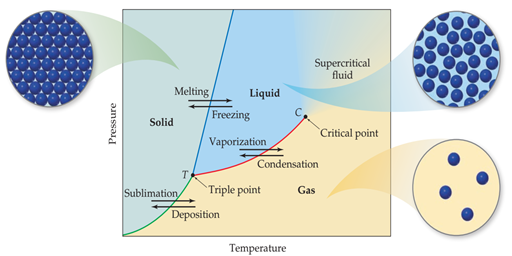
El equilibrio entre un líquido y su vapor no es el único equilibrio dinámico que puede existir entre los estados de la materia. En condiciones apropiadas, un sólido puede estar en equilibrio con su líquido o incluso con su vapor. La temperatura a la que coexisten las fases sólida y líquida en el equilibrio es el punto de fusión del sólido o el punto de congelación del líquido. Los sólidos también pueden sufrir evaporación y, por lo tanto, poseen una presión de vapor. Un diagrama de fase es una forma gráfica de resumir las condiciones bajo las cuales existen equilibrios entre los diferentes estados de la materia. Dicho diagrama también nos permite predecir qué fase de una sustancia está presente a una temperatura y presión determinadas.
Figura 19. El diagrama de fase. Es una gráfica de presión contra temperatura a volumen
constante, que relaciona las posibles configuraciones o estados de la materia
que puede adquirir una sustancia volátil al cambiar ambas variables.
El diagrama de fases para cualquier sustancia que pueda
existir en las tres fases de la materia se muestra en la Figura
19. El diagrama contiene tres
curvas importantes, cada una de las cuales representa la temperatura y la
presión a la que las distintas fases pueden coexistir en el equilibrio, y al
mismo tiempo representan los puntos críticos de cambio de fase, por ejemplo, la
roja indica los puntos de ebullición al variar la presión. La única sustancia
presente en el sistema es aquella cuyo diagrama de fase está bajo
consideración. La presión que se muestra en el diagrama es la presión aplicada
al sistema o la presión generada por la sustancia. Las curvas se pueden
describir como sigue:
La curva roja es la curva de presión de vapor del líquido,
que representa el equilibrio entre las fases líquida y gaseosa. El punto en
esta curva donde la presión de vapor es 1 atm es el punto de ebullición normal
de la sustancia. La curva de presión de vapor termina en el punto crítico (C),
que corresponde a la temperatura crítica y la presión crítica de la sustancia.
A temperaturas y presiones más allá del punto crítico, las fases líquida y
gaseosa son indistinguibles entre sí, y la sustancia es un fluido supercrítico.
La curva verde, la curva de sublimación, separa la fase
sólida de la fase gaseosa y representa el cambio en la presión de vapor del
sólido cuando se sublima a diferentes temperaturas. Cada punto en esta curva es
una condición de equilibrio entre el sólido y el gas.
La curva azul, la curva de fusión, separa la fase sólida de
la fase líquida y representa el cambio en el punto de fusión del sólido al
aumentar la presión. Cada punto en esta curva es un equilibrio entre el sólido
y el líquido. Esta curva generalmente se inclina ligeramente hacia la derecha a
medida que aumenta la presión porque, para la mayoría de las sustancias, la
forma sólida es más densa que la forma líquida. Un aumento de la presión suele
favorecer la fase sólida más compacta, aunque se requiere MUCHA; por lo tanto,
se requieren temperaturas más altas para fundir el sólido a presiones más altas.
El punto de fusión a 1 atm es el punto de fusión normal.
El punto T, donde las tres curvas se intersecan, es el punto
triple, y aquí las tres fases están en equilibrio.
(33)
Cualquier otro punto en cualquiera de las tres curvas
representa el equilibrio entre dos fases. Cualquier punto del diagrama que no
caiga en una de las curvas corresponde a las condiciones en las que solo está
presente una fase. La fase gaseosa, por ejemplo, es estable a bajas presiones y
altas temperaturas, mientras que la fase sólida es estable a bajas temperaturas
y altas presiones. Los líquidos son estables en la región entre los otros dos.
Los problemas de lápiz y papel de punto triple no son particularmente
complejos, simplemente se basan en buscar el intersecto de la condición final 1
para determinar la condición final 2, en este caso el instrumento predictivo
deja de ser una fórmula, y se convierte en la gráfica, lo difícil es que la
gráfica sea clara.
Conteste las siguientes preguntas
cualitativas para el diagrama de fase para el xenón.
¿En qué fase se encuentra el xenón a en condiciones estándar?
Las condiciones estándar son 0
°C y 1 atm, la gráfica nos indica que todo por encima de -105 °C es un gas, lo
cual se evidencia por el hecho de que el xenón es un gas noble.
Si la presión ejercida sobre el xenón es de 0,75 atm a -114°C ¿En
qué fase se encuentra el xenón?
Aproximamos -114 a -115. La
gráfica es molesta ya que no proporciona el 0,75, por lo que puede estar en
estado sólido o líquido, o incluso en el punto de equilibrio de sólido a
líquido.
¿Cuál es la presión de vapor a -120°C?
Empleamos las rectas de ayuda
de la gráfica, siendo el resultado 0,37 atm




No hay comentarios:
Publicar un comentario