(Ciencias de Joseleg) (Química) (Química cuantitativa) (Disoluciones
y propiedades coligativas) (Ejercicios) (Introducción) (Generalidades) (Mezclas
homogéneas y heterogéneas) (Mezclas
homogéneas o disoluciones) (Tipos
de disoluciones) (Introducción
a las unidades de concentración) (Porcentaje
en masa) (Notación
partes por) (Porcentaje
volumen a volumen) (Porcentaje
masa a volumen) (Concentración
molar) (Concentración
normal) (Peso
equivalente y factor equivalente) (Concentración
molal) (Fracción
molar) (Conversiones
entre unidades de concentración líquidas)
(Unidades
de concentración en gases) (Conversiones
de unidades de concentración gaseosas)
(Cambios
de concentración subcríticos) (Alícuotas,
destilaciones y mezclas) (Referencias
bibliográficas)
Al igual que sucede con gases o con las propiedades ponderales, las leyes que hemos definido para las unidades de concentración tienen dos formas, una estática, que es la que hemos visto, y otra dinámica o para variables de estado. En una variable de estado, lo único que nos importa son los estados inicial y final del sistema, pero no nos importa lo que sucede en medio. De lo anterior se deduce que vamos a tener que introducir los conceptos de inicial y final. Las variables iniciales van a estar marcadas con un superíndice cero, por ejemplo, masa inicial total m0, y las variables en su estado final van a ir sin marca, por ejemplo, la masa total final m.
La concentración es una función de dos variables, soluto y
solvente, por ende, se puede alterar la concentración alterando el soluto y/o
alterando el solvente. En la práctica estos procesos están limitados, en
generar es muy fácil adicionar soluto y/o solvente, pero retirarlos es más
complejo.
Cambios
de concentración por adición
La concentración
aumenta al adicionar soluto y disminuye al adicionar el solvente. Por lo
general, adicionar solvente a una solución se denomina diluir la solución, para
disminuir su concentración. Por ejemplo, el ácido clorhídrico generalmente se
vende a una concentración de 12
M, pero para las actividades y prácticas experimentales pueden usarse
concentraciones desde 1
M hasta 1×10-6 M. Los cambios en las unidades de
concentración se basan en el hecho de que experimentalmente lo más fácil es
cambiar la cantidad de solvente, por lo que las masas de soluto entre dos
momentos es una constante.
Cambios
de concentración por evaporación y destilación
Si el solvente es más volátil que el soluto, calentar la
solución permite aumentar la concentración al disminuir la cantidad de
solvente. Por el contrario, si el soluto es más volátil que el solvente al
calentar la concentración disminuye. Si su objetivo es aumentar la
concentración de un solvente volátil, debe capturar el vapor y condensarlo,
proceso denominado destilación.
Matemáticas del cambio de concentración
El modelo matemático más común para esta situación es el que
describe a la cantidad de soluto como una constante: ya sea cantidad de
sustancia (ni0=ni),
o masa (mi0=mi).
Con base a esta condición, es posible deducir las ecuaciones de cambio de
concentración.
Deducción
Si tomamos la ecuación que define la fracción de masas.
y dividimos cada uno de los términos entre su
versión inicial, pero asumiendo que la masa del soluto es constante:
Aunque la ecuación anterior ya
está lista para usarse, generalmente se la presenta linealizada con todos los términos
iniciales a un lado y los finales al otro.
(195)
El mismo proceso puede hacerse para la concentración molar.
Deducción
Si tomamos la ecuación que define la concentración molar.
y dividimos cada uno de los términos entre su
versión inicial, pero asumiendo que la cantidad de sustancia del soluto es
constante:
Aunque la ecuación anterior ya
está lista para usarse, generalmente se la presenta linealizada con todos los términos
iniciales a un lado y los finales al otro.
(196)
Las ecuaciones anteriores nos permiten determinar los
cambios de concentración al agregar o disminuir la cantidad de solvente o
volumen final.
Ejemplo.
Determine el porcentaje en masa
final si a una solución al 12% en masa de masa total 50 g, la llevamos a 200 g.
Solución analítica: Empleamos
la ecuación (195), despejando la fracción de masa final.
Opcional. Convertimos fracción
de masas a partes por ciento.
Solución numérica:
La respuesta es 6 %.
Ejemplo.
¿Si deseamos llevar una solución del
12% en masa al 10% en masa, a cuanto debemos llevar la masa total adicionando
agua, si la masa inicial es de 100 g?
Solución analítica: Empleamos
la ecuación (195), despejando la masa total final.
Opcional. Convertimos fracción
de masas a partes por ciento.
Solución numérica
Ejemplo.
Una solución inicial al 8 M en 500
ml de agua se llevó a 2000 ml. ¿Cuál es la concentración después de agregar ese
volumen?
Solución analítica: Empleamos
la 196 despejando la variable pertinente.
Solución numérica: Convierta
molar a mol/L
Algunas unidades de concentración como la fracción de masas
permiten preguntar sobre la adición de solvente sin dar la masa total, miremos
esa situación.
Demostración
Deduzca una ecuación para el cambio de fracción de masas que permita usar la masa de solvente adicionada en el momento final. Iniciamos con la ecuación (195):
La masa total final es la suma
de la masa total inicial más la masa de solvente adicionada.
Y simplificamos.
(197)
Miremos un ejemplo numérico.
Ejemplo.
Cuál es el porcentaje en masa final
de una solución de masa total de 100 g al 20% a la cual se le adicionó 80g de
solvente.
Solución analítica: Despejamos
la fracción de masas final de la ecuación anterior.
Opcional. Convertimos fracción
de masas a partes por ciento.
Solución numérica
La respuesta será de 11%.
El caso opuesto, en que se retire una cantidad de solvente,
se modela con una resta.
Todas las unidades de concentración pueden convertirse a una
forma dinámica. Que consiste en el producto de la unidad de concentración por
el valor que describe a la solución total (como el volumen total) o a la
cantidad de solvente. A continuación, expondremos dichas ecuaciones:
(198)
(199)
(200)
(201)
(202)
(203)
(204)
En ocasiones podemos tener mezclas de unidades de
concentración, la más común es tener un frasco de ácido definido con porcentaje
en masa, y densidad como momento inicial, y la concentración molar como momento
final.
Demostración
Iniciamos con
La situación inicial está dada
en porcentaje en masa, por lo que necesitaremos masa al inicio.
La masa de soluto la
reemplazamos por el producto fracción por masa total, y la cantidad de
sustancia por el producto concentración molar por volumen total
El problema no me da la masa
total, así que lo reemplazamos por el producto densidad inicial por volumen
inicial.
Despejamos el volumen inicia.
(205)
Solución analítica: emplearemos
la ecuación anterior, pero reemplazando inicialmente los términos que no
cambian.
Solución numérica: Convierta porcentaje a fracción de masas dividiendo entre 100. A adicionalmente hay que convertir de ml a L.
Ahora evaluamos para cada valor de concentración convirtiendo M a mol/L:
Ejemplo 1. El ácido sulfúrico H2SO4 (98 g/mol)
lleva la siguiente información en su etiqueta comercial, 49% en masa con una
densidad de 1,4 g/ml. Determinar el volumen en ml de ácido concentrado que
requiero para formar 250 ml de una disolución de: 1 M, 2 M, 0,5 M, 0,1 M, 0,01
M.
Solución analítica: Este
problema tiene la misma estructura que el problema anterior aplicamos la
ecuación (205)
Solución numérica:
Dado que hay varias
concentraciones, procesaremos los términos constantes. Convierta porcentaje a
fracción de masas. A adicionalmente hay que convertir de ml a L.
Ahora solo es evaluar cada una
de las concentraciones:































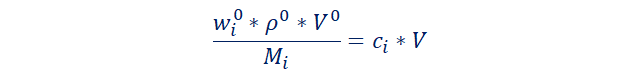






No hay comentarios:
Publicar un comentario