(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(La
ley de Henry) (Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
Una solución es una mezcla homogénea de dos o más sustancias. La sustancia presente en mayor cantidad se suele llamar solvente y las otras sustancias se denominan solutos; se dice que están disueltos en el disolvente. Cuando se disuelve una pequeña cantidad de cloruro de sodio (NaCl) en una gran cantidad de agua, por ejemplo, el agua es el solvente y el cloruro de sodio es el soluto. Sin embargo, una vez disuelto el soluto pueden ocurrir dos cosas, la primera es que la molécula se integre a la red de enlaces de hidrógeno, pero siga existiendo como molécula. La otra es que se genere una segunda reacción en la que la molécula se descompone en los electrolitos.
Desde pequeños aprendemos a no llevar aparatos eléctricos a
la bañera para no electrocutarnos. Esa es una lección útil porque la mayor
parte del agua que encontramos en la vida diaria es conductora de electricidad
por estar impura. El agua pura, sin embargo, es un conductor de electricidad
muy pobre. La conductividad del agua del baño se origina en las sustancias
disueltas en el agua, no en el agua en sí.
No todas las sustancias que se disuelven en agua hacen que
la solución resultante sea conductora. Los experimentos muestran que algunas
soluciones conducen la electricidad mejor que otras. Imagine, por ejemplo,
preparar dos soluciones acuosas: una disolviendo una cucharadita de sal de mesa
(cloruro de sodio) en una taza de agua y la otra disolviendo una cucharadita de
azúcar de mesa (sacarosa) en una taza de agua).
Figura 3. La finalización de un circuito eléctrico con
un electrolito enciende la luz, de izquierda a derecha, el agua pura no completa el circuito y tampoco un compuesto molecular, pero el cloruro de sodio al ser un compuesto ionico y ionizable (las dos cosas no necesariamente van de la mano) si completa el circuito y la bombilla se enciende.
Ambas soluciones son transparentes e incoloras, pero poseen
conductividades eléctricas
muy diferentes: la solución
salina es un buen conductor de electricidad, lo cual podemos ver al encender la
bombilla. Para que la bombilla de la Figura 3
se encienda, debe haber una corriente eléctrica (es decir, un flujo de
partículas cargadas eléctricamente) entre los dos electrodos sumergidos en la
solución. La conductividad del agua pura no es suficiente para completar el
circuito eléctrico y encender la bombilla. La situación cambiaría si los iones
estuvieran presentes en la solución, porque los iones llevan carga eléctrica de
un electrodo a otro, completando el circuito. Por tanto, la conductividad de
las soluciones de NaCl indica la presencia de iones. La falta de conductividad
de las soluciones de sacarosa indica la ausencia de iones. Cuando el NaCl se
disuelve en agua, la solución contiene iones Na(+) y Cl(-), cada uno rodeado
por moléculas de agua. Cuando la sacarosa C12H22O11
se disuelve en agua, la solución contiene solo moléculas de sacarosa neutras
rodeadas por moléculas de agua.
Una sustancia como el NaCl cuyas soluciones acuosas
contienen iones se llama electrolito. Una sustancia (como el C12H22O11
que no forma iones en solución se denomina no electrolito. Las diferentes
clasificaciones de NaCl y C12H22O11 surgen en
gran medida porque el NaCl es un compuesto iónico, mientras que el C12H22O11
es un compuesto molecular. Adicionalmente, algunas sales son solo conductoras a
medias, o débiles en comparación con otras, de allí que reciben el nombre de
electrolitos débiles.
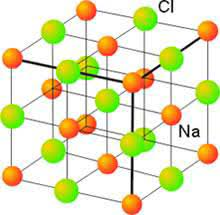
El NaCl sólido consiste en una disposición ordenada de iones
Na(+) y Cl(-). Cuando el NaCl se disuelve en agua, cada ion se separa de la
estructura sólida y se dispersa por toda la solución. El sólido iónico se
disocia en sus iones componentes a medida que se disuelve.
Figura 4. Modelo del
sólido cristalino que forman los iones sodio(1+) y cloruro(1-)
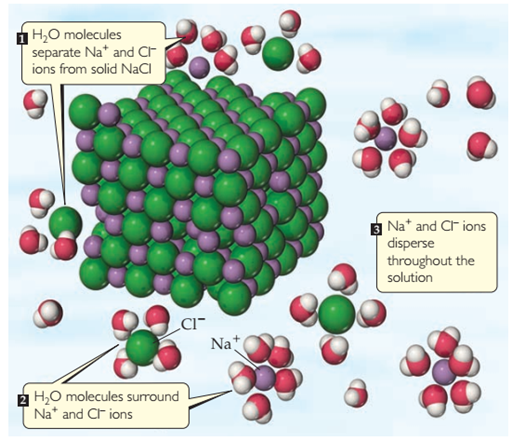
Figura 5. Cuando un compuesto iónico, como el cloruro
de sodio, NaCl, se disuelve en agua, las moléculas de H2O separan,
rodean y dispersan uniformemente los iones en el líquido.
El agua es un disolvente muy eficaz para los compuestos
iónicos. Aunque el H2O es una molécula eléctricamente neutra, el
átomo de O es rico en electrones y tiene una carga negativa parcial, mientras
que cada átomo de H tiene una carga positiva parcial.
La letra griega minúscula delta δ se usa
para denotar carga parcial: una carga parcial negativa se denota δ-
(“delta menos”), y una carga parcial positiva se denota por δ+
(“delta más”). Los cationes son atraídos por el extremo negativo de H2O
y los aniones son atraídos por el extremo positivo.
A medida que se disuelve un compuesto iónico, los iones
quedan rodeados por moléculas de H2O, como se muestra en la Figura 5.,
se dice que los iones están solvatados cuando quedan rodeados completamente. En
ecuaciones químicas, denotamos iones solvatados escribiéndolos como Na+(aq)
y Cl-(aq), donde aq es una abreviatura de "acuoso". La
solvatación ayuda a estabilizar los iones en solución y evita que los cationes
y aniones se recombinen. Además, debido a que los iones y sus capas de las
moléculas de agua circundantes pueden moverse libremente, los iones se
dispersan uniformemente por toda la solución.
Por lo general, podemos predecir la naturaleza de los iones
en una solución de un compuesto iónico a partir del nombre químico de la
sustancia. El sulfato de sodio (Na2SO4), por ejemplo, se
disocia en iones de sodio Na+ e iones de sulfato SO42-.
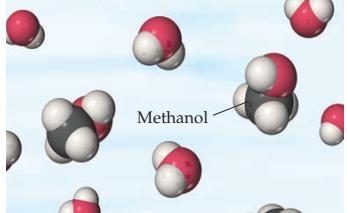
Figura 6. Las sustancias moleculares que se disuelven
en agua, como el metanol, CH3OH, suelen hacerlo sin formar iones.
Podemos pensar en el metanol en el agua como una simple mezcla de dos especies
moleculares. Tanto en (a) como en (b) las moléculas de agua se han separado
para que las partículas de soluto puedan verse claramente.
Cuando un compuesto molecular como la sacarosa o el metanol Figura 6
se disuelve en agua, la solución generalmente consta de moléculas intactas
dispersas por toda la solución. En consecuencia, la mayoría de los compuestos
moleculares no son electrolitos. Algunas sustancias moleculares tienen
soluciones acuosas que contienen iones. Los ácidos son las más importantes de
estas soluciones. Por ejemplo, cuando el cloruro de hidrógeno HCl(g) se
disuelve en agua para formar ácido clorhídrico, HCl (aq), la molécula se ioniza;
es decir, se disocia en iones H+(aq) y Cl-(aq).
Los electrolitos difieren en la medida en que conducen la
electricidad. Los electrolitos fuertes son aquellos solutos que existen en
solución completa o casi completamente como iones. Básicamente, todos los
compuestos iónicos solubles en agua (como el NaCl) y algunos compuestos
moleculares (como el HCl) son electrolitos fuertes. Los electrolitos débiles
son aquellos solutos que existen en solución principalmente en forma de
moléculas neutras con solo una pequeña fracción en forma de iones. Por ejemplo,
en una solución de ácido acético CH3COOH, la mayor parte del soluto
está presente como moléculas de CH3COOH(aq). Sólo una pequeña
fracción (alrededor del 1%) del CH3COOH se ha disociado en iones H+(aq)
y CH3COO-(aq).
Debemos tener cuidado de no confundir la medida en que un
electrolito se disuelve (su solubilidad) con si es fuerte o débil, y para
evitar esta confusión, podemos modelarlo como dos reacciones químicas
encadenadas y ben equilibrio.
(1)
En la primera reacción que va del sólido al acuoso tenemos
la solubilización, mientras que en la segunda reacción, del acuoso a los iones,
tenemos la ionización.
Las medias flechas que apuntan en direcciones opuestas
significan que la reacción es significativa en ambas direcciones, aunque eso
depende de la sustancia y las condiciones físicas como la temperatura. El
equilibrio entre estos procesos opuestos determina el número relativo de iones
y moléculas neutras. Este equilibrio produce un estado de equilibrio químico en
el que los números relativos de cada tipo de ion o molécula en la reacción son
constantes en el tiempo. Los químicos usan medias flechas que apuntan en
direcciones opuestas para representar reacciones que van tanto hacia adelante
como hacia atrás para lograr el equilibrio, como la ionización de electrolitos
débiles.
Por el contrario, una sola flecha de reacción se utiliza
para reacciones que avanzan en gran medida, como la ionización de electrolitos
fuertes. Debido a que el HCl es un electrolito fuerte, escribimos la ecuación
para la ionización del HCl como
(2)
La flecha → indica que una vez se han formado los iones, no
debe haber HCl medible en la solución.
Aunque formalmente la conductividad eléctrica no se
considera una propiedad coligativa, su comportamiento sigue las características
de estas, es decir, una casi linealidad a bajas concentraciones y una
desviación de esto a altas concentraciones, además de ser un concepto que ha
aparecido en las pruebas de estado colombianas varias veces, así que vale la
pena introducir el concepto.
La conductividad (o conductancia específica) de una solución de electrolito es una medida de su capacidad para conducir electricidad, cosa que ya vimos en el experimento de los bombillos (Figura 3). La unidad de conductividad SI es Siemens por metro (S / m). Lo que no nos explican en el experimento de los bombillos es que la concentración de todos los electrolitos empleada en dicho experimento es baja, pues si aumentáramos mucho la concentración, de por ejemplo un electrolito fuerte, la bombilla no se encendería.
Figura 7. Curva de conductividad contra concentración. Efecto de la
concentración sobre la conductividad, la cual es directamente proporcional a
bajas concentraciones, e inversamente proporcional a altas concentraciones.
Esta tendencia puede no ser extraña, las propiedades coligativas se modelan
linealmente a bajas c oncentraciones.
Las mediciones de conductividad se utilizan de forma
rutinaria en muchas aplicaciones industriales y ambientales como una forma
rápida, económica y confiable de medir el contenido
iónico en una solución. Por ejemplo, la medición de la conductividad
del producto es una forma típica de monitorear y mejorar continuamente el
rendimiento de los sistemas de purificación de agua. Por ende, la conductividad
es una propiedad casi exclusiva de las disoluciones con electrolitos fuertes o
débiles, mientras que un no electrolito manifiesta 0 conductividad.
Sin embargo, la conductividad tiene un giro, aunque
inicialmente son proporcionales, a mayor concentración de iones, mayor
conductividad, cuando se alcanza cierto umbral de concentración, la relación se
hace inversamente proporcional, así a concentraciones muy altas, la
conductividad disminuye. La gráfica generada tiene forma de montaña y aunque
sus valores difieren de soluto a soluto Figura 7.
Ese es otro detalle que la conductividad comparte con las propiedades
coligativas, en general los modelos que hacemos de estas solo funcionan para
rangos de concentración bajos, es decir, solutos altamente diluidos, pues a
mayores concentraciones ocurren desviaciones de lo esperado.
La principal razón por la cual la conductividad no se
considera una propiedad coligativa es que estas no solo dependen de la
concentración, sino también de las propiedades químicas de la sustancia. Por
ejemplo, aunque los no electrolitos si poseen propiedades coligativas que
dependen de su cantidad de sustancia, estos tendrán nulas conductividades.






No hay comentarios:
Publicar un comentario