(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(La
ley de Henry) (Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
Hablamos bastante de las interacciones moleculares en la unidad de enlace químico, así que por el momento para términos prácticos solo nos enfocaremos en las interacciones debidas a momentos de polaridad, ya sea permanentes en las moléculas iónicas como el cloruro de sodio o momentáneas con tendencia a un átomo muy electronegativo como en la molécula de agua; estas interacciones polares fuertes se contraponen a interacciones no polares que aumentar su fuerza en la medida que la molécula se hace más grande.
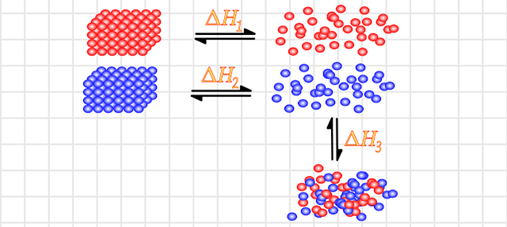
Figura 10. Pasos para la formación de una solución. Para que una disolución homogénea se forme deben
involucrarse tres cambios energéticos, uno para el soluto, otro para el
solvente y el tercero para la mezcla.
Estas definiciones se basaban en una muestra elemental pura,
por ejemplo, un gas como en helio posee muy pocas interacciones ya que es una
molécula de un solo átomo neutral, sin embargo, ahora debemos tener en cuenta
lo que sucede en una mezcla.
Tres tipos de interacciones intermoleculares están
implicadas en la formación de la solución: (1) Las interacciones soluto-soluto,
la unión entre las partículas de un mismo tipo deben ser superadas para
dispersar las partículas del soluto a través del solvente; (2) Las interacciones
solvente-solvente, la unión entre las partículas de disolvente deben superarse
para dejar espacio para las partículas de soluto en el disolvente; (3) Las
interacciones solvente-soluto, estas solo se dan cuando las partículas se
mezclan de manera solubilizada. Lo anterior se resume con la siguiente idea,
los dos componentes puros poseen un orden molecular que debe romperse para
poder mezclarse. Para que el proceso sea espontáneo el estado energético final
debe ser menor que el de los dos miembros de la solución por separado.
La medida en que una sustancia puede disolverse en otra
depende de las magnitudes relativas de estos tres tipos de interacciones,
aunque existen técnicas heurísticas que permiten evaluar con rapidez la
probable solubilidad de dos sustancias. Las soluciones se forman cuando las
magnitudes de las interacciones disolvente-soluto son comparables o mayores que
las interacciones soluto-soluto y disolvente-disolvente. Por ejemplo, el
heptano y el pentano se disuelven entre sí en todas las proporciones. Para esta
discusión, podemos llamar arbitrariamente heptano el disolvente y pentano el
soluto. Ambas sustancias son no polares y las magnitudes de las interacciones
disolvente-soluto (fuerzas de dispersión atractivas) son comparables a las
interacciones soluto-soluto y disolvente-disolvente. Por lo tanto, ninguna
fuerza impide la mezcla, y la tendencia a mezclar (aumentar la entropía) hace
que la solución se forme espontáneamente.
El cloruro de sodio sólido se disuelve fácilmente en agua
debido a que las interacciones solvente-soluto entre las moléculas de agua y
los iones son lo suficientemente fuertes como para superar las atractivas
interacciones soluto-soluto entre los iones en el cloruro de sodio y las
interacciones solvente-disolvente entre moléculas de agua. Cuando se agrega
cloruro de sodio al agua, las moléculas de agua se orientan sobre la superficie
de los cristales de cloruro de sodio con el extremo positivo del dipolo de agua
orientado hacia los iones cloruro(1-) y el extremo negativo orientado hacia los
iones sodio(1+). Estas atracciones de iones-dipolo son lo suficientemente
fuertes para tirar de los iones de superficie lejos del sólido, superando así
las interacciones soluto-soluto. Para que el sólido se disuelva, algunas
interacciones solvente-disolvente también deben ser superadas para crear
espacio para que los iones se "encajen" entre todas las moléculas de
agua.
Una vez separados del sólido, los iones sodio(1+) y
cloruro(1-) están rodeados por moléculas de agua. Las interacciones como ésta
entre el soluto y las moléculas de disolvente se conocen como solvatación.
Cuando el disolvente es agua, las interacciones se denominan hidratación.
Los procesos de disolución típicamente se acompañan de
cambios en la entalpía. Por ejemplo, cuando NaCl se disuelve en agua, el
proceso es ligeramente endotérmico, ΔHT
= 3,9 kJ / mol. Podemos utilizar la ley de Hess para analizar cómo
las interacciones soluto-soluto, solvente-disolvente y disolvente-disolvente
influyen en la entalpía de la solución. Podemos imaginar que el proceso de
solución tiene tres componentes, cada uno con un cambio de entalpia asociado:
Un grupo de n partículas de solutos deben separarse entre sí ΔHa, un grupo de m partículas
disolventes separadas entre sí ΔHb, y estas partículas de
soluto y solvente mezclan ΔHm. De esta forma podemos obtener el cambio de
entalpía final en términos de las entalpias de cada uno de los pasos
independientes.
(3)
La separación de las partículas de soluto entre sí requiere
siempre una entrada de energía para superar interacciones de atracción. El
proceso es por lo tanto endotérmico ΔHa > 0. Igualmente, la
separación de moléculas de disolvente para acomodar al soluto siempre requiere
energía ΔHb
> 0. El tercer componente, que surge de las interacciones atractivas
entre las partículas de soluto y las partículas de disolvente, es siempre
exotérmico ΔHm
< 0.
Los tres términos de entalpía en la ecuación (1) pueden
agregarse juntos para dar una suma positiva o negativa, dependiendo de los
números reales para el sistema considerado. Así, la formación de una solución
puede ser exotérmica o endotérmica. Por ejemplo, cuando se añade sulfato de
magnesio al agua, el proceso en solución es exotérmico: ΔHT = —91,2 kJ / mol.
Por el contrario, la disolución del nitrato de amonio es endotérmica: ΔHT = 26,4 kJ / mol.
Estas sales particulares son los componentes principales en los paquetes de
calor instantáneos y los paquetes de hielo usados para tratar lesiones atléticas.
Los paquetes consisten en una bolsa de agua y la sal sólida sellada del agua,
sulfato de magnesio para paquetes calientes y nitrato de amonio para paquetes
fríos. Cuando se comprime el paquete, se rompe el sello que separa el sólido
del agua y se forma una solución, aumentando o disminuyendo la temperatura.
El cambio de entalpía para un proceso puede proporcionar una
visión en la medida en que el proceso se produce. Los procesos exotérmicos
tienden a proceder espontáneamente. Por otro lado, si ΔHT es demasiado endotérmico,
el soluto podría no disolverse de forma significativa en el disolvente
escogido. Por lo tanto, para que las soluciones se formen, la interacción
disolvente-soluto debe ser lo suficientemente fuertes como para que ΔHm sea comparable
en magnitud a ΔHa+ΔHb.
Este hecho explica además por qué los solutos iónicos no se disuelven en
disolventes no polares. Las moléculas de disolvente no polar experimentan
solamente interacciones atractivas débiles con los iones, y estas interacciones
no compensan las energías requeridas para separar los iones entre sí.
Por un razonamiento similar, un soluto líquido polar, tal
como agua, no se disuelve en un disolvente líquido no polar, tal como octano.
Las moléculas de agua experimentan fuertes interacciones de enlace de hidrógeno
entre sí, fuerzas atractivas que deben superarse si las moléculas de agua han
de dispersarse a través del disolvente de octano. La energía necesaria para
separar las moléculas de H2O entre sí no se recupera en forma de
interacciones atractivas entre las moléculas de H2O y de octano.



No hay comentarios:
Publicar un comentario