(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
La solubilidad es la propiedad de una sustancia química sólida, líquida o gaseosa llamada soluto para disolverse en un solvente sólido, líquido o gaseoso. Las interacciones entre el soluto y el disolvente determinarán si se formará una solución. Inicialmente, se necesita energía para separar las partículas en el soluto y las partículas de disolvente. Entonces se libera energía cuando las partículas de soluto se mueven entre las partículas de disolvente para formar una solución. Sin embargo, debe haber atracciones entre el soluto y las partículas de disolvente para proporcionar la energía para la separación inicial. Estas atracciones se producen cuando el soluto y el disolvente tienen polaridades similares. La expresión "lo semejante disuelve lo semejante" es una manera de decir que las polaridades de un soluto y un disolvente deben ser similares para que una solución se forme. En ausencia de interacciones moleculares atractivas entre un soluto y un disolvente, no se forma una solución.
Figura 1. Representación estándar de una solución con
diferentes grados de saturación. La
figura tiene un problema y es que no diferencia claramente la solución
insaturada de la saturada, ya que ese concepto es matemático.
El término solubilidad se utiliza para describir la cantidad
de un soluto que puede disolverse en una cantidad dada de disolvente. Muchos
factores, como el tipo de soluto, el tipo de disolvente y la temperatura,
afectan a la solubilidad de un soluto. La solubilidad, usualmente expresada en
gramos de soluto en 100 g de disolvente, pero puede expresarse en cualquiera de
las unidades de concentración como molaridad, molalidad o porcentaje en masa y,
es la cantidad máxima de soluto que puede disolverse a cierta temperatura.
El nivel de saturación indica el punto crítico por el cual
decimos si un sólido soluble deja de serlo.
Matemáticamente la
podemos modelar como que la masa de soluto m(s) es menor que la masa máxima m(max) que puede aguantar una determinada cantidad
de solvente. La solución insaturada es homogénea.
Una analogía
macroscópica consiste en que el solvente es un bus con una determinada cantidad
de cupos, y el soluto son los pasajeros. En una solución insaturada hay más
cupos que pasajeros.
Matemáticamente la
podemos modelar como que la masa de soluto m(s) es igual que la masa máxima m(max) que puede aguantar una determinada cantidad
de solvente. La solución insaturada es homogénea.
En la analogía
macroscópica la idea es que todos los pasajeros van sentados, pero no hay
cupos. Cualitativamente, las soluciones saturadas e insaturadas pueden verse de
manera semejante a menos que el soluto presente algún tipo de pigmento visible
como la Figura
1, sin embargo, en soluciones comunes como
sal en agua o azúcar en agua, las soluciones saturadas e insaturadas no pueden
distinguirse por cualidades visibles, aunque si cambiarán en cualidades
organolépticas como el sabor.
Matemáticamente la
podemos modelar como que la masa de soluto m(s) es mayor que la masa máxima m(max) que puede aguantar una determinada cantidad
de solvente. La solución sobresaturada es heterogénea ya que la masa que no
aguanta el solvente se separa espontáneamente del líquido, ya sea en fase
sólida “como precipitado”, o en fase gaseosa “atmósfera sobre el líquido”.
Básicamente en
términos cualitativos solo la solución sobresaturada se distingue ya que tendrá
precipitado, mientras que en las otras dos lo que se observa es el solvente
como si no estuviera mezclado con otras cosas. Sin embargo, una solución sobresaturada
puede aparentar ser homogénea.
Algunos solutos,
como el acetato de sodio, no se recristalizan fácilmente. Suponga que se
prepara una solución exactamente saturada de acetato de sodio a 50 ° C. A
medida que vuelve a enfriarse a temperatura ambiente, no aparecen cristales en
la solución, aunque la solubilidad del acetato de sodio es menor a temperatura
ambiente. Una solución supersaturada es una solución que contiene más de la
cantidad máxima de soluto que se puede disolver a una temperatura determinada.
La recristalización del exceso de soluto disuelto en una solución sobresaturada
puede iniciarse mediante la adición de un diminuto cristal de soluto, llamado
cristal semilla. El cristal semilla proporciona un sitio de nucleación en el que
el exceso de cristales disueltos puede comenzar a crecer. La recristalización
en una solución sobresaturada suele ser muy rápida.
La medida en que
una sustancia se disuelve en otra depende de la naturaleza de ambas sustancias.
También depende de la temperatura y, al menos para los gases, de la presión.
La tendencia
natural de las sustancias a mezclarse y las diversas interacciones entre las
partículas de soluto y disolvente están implicadas en la determinación de las
solubilidades. Sin embargo, a menudo se puede obtener información sobre las
variaciones en la solubilidad centrándose en la interacción entre el soluto y
el disolvente.
Las solubilidades
de varios gases en agua aumentan al aumentar la masa de sus moléculas. Las
fuerzas de atracción entre las moléculas de gas y las moléculas de disolvente
son principalmente fuerzas de dispersión, que aumentan al aumentar el tamaño y
la masa molecular. Por lo tanto, los datos indican que las solubilidades de los
gases en el agua aumentan a medida que aumenta la atracción entre el soluto
(gas) y el solvente (agua). En general, cuando otros factores son comparables,
cuanto más fuertes son las atracciones entre las moléculas de soluto y
disolvente, mayor es la solubilidad del soluto en ese disolvente.
Debido a las
favorables atracciones dipolo-dipolo entre las moléculas de solvente y las
moléculas de soluto, los líquidos polares
tienden a disolverse en solventes polares. El agua es polar y puede
formar enlaces de hidrógeno. Por lo tanto, las moléculas polares, especialmente
aquellas que pueden formar enlaces de hidrógeno con moléculas de agua, tienden
a ser solubles en agua. Por ejemplo, la acetona, una molécula polar, se mezcla
en todas las proporciones con agua. La acetona tiene un enlace C=O fuertemente
polar y pares de electrones no enlazados en el átomo de O que pueden formar
enlaces de hidrógeno con el agua. Esto nos lleva a una regla que siguen
básicamente todas las sustancias orgánicas, y es que entre mayor cantidad de
oxígenos y entre más desnudos estén estos oxígenos, más solubles van a hacer
las sustancias orgánicas en agua.
Los líquidos que se
mezclan en todas las proporciones, como la acetona y el agua, son miscibles,
mientras que los que no se disuelven entre sí son inmiscibles. La gasolina, que
es una mezcla de hidrocarburos, es inmiscible con agua, y por ende forma una
mezcla heterogénea. Los hidrocarburos son sustancias apolares debido a varios
factores: los enlaces C - C no son polares, los enlaces C - H son casi no
polares y las moléculas son lo suficientemente simétricas como para cancelar
gran parte de los dipolos débiles del enlace C - H. La atracción entre las
moléculas de agua polares y las moléculas de hidrocarburos no polares no es lo
suficientemente fuerte como para permitir la formación de una solución. De hecho,
podemos visualizar el proceso como si la red de puentes de hidrógeno del agua
excluyera activamente a todas aquellas moléculas incapaces de realizar enlaces
de hidrógeno.
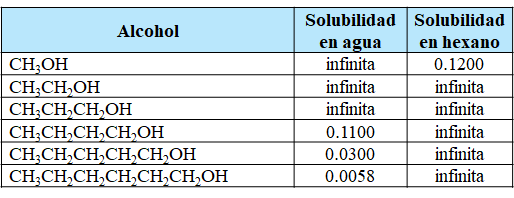
Muchos compuestos
orgánicos tienen grupos polares unidos a una estructura no polar de átomos de
carbono e hidrógeno. Por ejemplo, la serie de compuestos orgánicos de la Tabla 1 contienen todos el grupo OH polar.
Tabla 1. Solubilidades de algunos alcoholes en agua y en hexano. Las solubilidades se expresan en mol de alcohol / 100 g de disolvente a 20 ° C.
Los compuestos orgánicos con esta característica molecular se denominan alcoholes. El
enlace O - H puede formar enlaces
de hidrógeno. Por ejemplo, las
moléculas de etanol CH3CH2OH pueden formar enlaces de hidrógeno con
moléculas de agua y entre sí. Como resultado, las fuerzas soluto-soluto,
solvente-solvente y soluto-solvente no son muy diferentes en una mezcla de CH3CH2OH y H2O. No se produce ningún cambio importante en los entornos de las
moléculas a medida que se mezclan. Por lo tanto, el aumento de entropía cuando
los componentes se mezclan juega un papel importante en la formación de la
solución, y el etanol es completamente miscible con agua.
El número de átomos
de carbono en un alcohol afecta su solubilidad en agua. A medida que aumenta
este número de carbonos, el grupo OH polar se convierte en una parte aún más
pequeña de la molécula y la molécula se comporta más como un hidrocarburo. La
solubilidad del alcohol en agua disminuye correspondientemente. Por otro lado,
la solubilidad de los alcoholes en un disolvente apolar como el hexano C6H14
aumenta a medida que se alarga la cadena de hidrocarburos apolares.
Una forma de
mejorar la solubilidad de una sustancia en agua es aumentar el número de grupos
polares que contiene la sustancia. Por ejemplo, aumentar el número de grupos OH
en un soluto aumenta el grado de enlace de hidrógeno entre ese soluto y el
agua, aumentando así la solubilidad. La glucosa C6H12O6,
tiene cinco grupos OH en una estructura de seis carbonos, lo que hace que la
molécula sea muy soluble en
agua: 830 g se disuelven en 1,00 L de agua a 17,5 ° C. Por el contrario, el ciclohexano C6H12,
que tiene una estructura similar a la glucosa pero con todos los grupos OH
reemplazados por H, es esencialmente insoluble en agua (solo 55 mg de
ciclohexano pueden disolverse en 1,00 L de agua a 25 ° C).
A lo largo de años
de estudio, el examen de diferentes combinaciones de solvente-soluto ha llevado
a una importante generalización: las sustancias con fuerzas de atracción
intermoleculares similares tienden a ser solubles entre sí. Esta generalización
a menudo se expresa simplemente como "lo
similar se disuelve como lo similar". Es más probable que las
sustancias no polares sean solubles en disolventes no polares; Es más probable
que los solutos iónicos y polares sean solubles en disolventes polares. Los
sólidos de la red, como el diamante y el cuarzo, no son solubles en disolventes
polares o apolares debido a la fuerte unión dentro del sólido.
Las vitaminas
tienen estructuras químicas únicas que afectan sus solubilidades en diferentes
partes del cuerpo humano. La vitamina C y las vitaminas B son solubles en agua,
por ejemplo, mientras que las vitaminas A, D, E y K son solubles en disolventes
no polares y en tejido graso (que es apolar). Debido a su solubilidad en agua,
las vitaminas B y C no se almacenan en un grado apreciable en el cuerpo, por lo
que los alimentos que contienen estas vitaminas deben incluirse en la dieta
diaria. Por el contrario, las vitaminas liposolubles se almacenan en cantidades
suficientes para evitar que aparezcan enfermedades por deficiencia de vitaminas
incluso después de que una persona haya subsistido durante un largo período con
una dieta deficiente en vitaminas.
Figura 2. Modelos moleculares de las estructuras de la
vitamina A y la vitamina C.
Que algunas
vitaminas sean solubles en agua y otras no se puede explicar en términos de sus
estructuras. Observe en la Figura 2 que la vitamina A (retinol) es un alcohol
con una cadena de carbono muy larga. Dado que el grupo OH es una parte tan
pequeña de la molécula, la molécula se parece a los alcoholes de cadena larga
que se enumeran en la Tabla 1. Esta vitamina es casi no polar. Por el
contrario, la molécula de vitamina C es más pequeña y tiene varios grupos OH
que pueden formar enlaces de hidrógeno con el agua, algo parecido a la glucosa.




No hay comentarios:
Publicar un comentario