(Ciencias de Joseleg) (Química) (Química cuantitativa) (Disoluciones
y propiedades coligativas) (Ejercicios) (Introducción) (Generalidades) (Mezclas
homogéneas y heterogéneas) (Mezclas
homogéneas o disoluciones) (Tipos
de disoluciones) (Introducción
a las unidades de concentración) (Porcentaje
en masa) (Notación
partes por) (Porcentaje
volumen a volumen) (Porcentaje
masa a volumen) (Concentración
molar) (Concentración
normal) (Peso
equivalente y factor equivalente) (Concentración
molal) (Fracción
molar) (Conversiones
entre unidades de concentración líquidas)
(Unidades
de concentración en gases) (Conversiones
de unidades de concentración gaseosas)
(Cambios
de concentración subcríticos) (Alícuotas,
destilaciones y mezclas) (Referencias
bibliográficas)
Es una unidad compleja pues tiene las mismas unidades de la densidad en su forma pura, tradicionalmente se define como la masa del soluto entre el volumen de la solución multiplicado por 100.
(33)
Aunque tendemos a usarla en términos de un porcentaje, el
significado original de esta unidad es el de una fracción simple, y recibe el
nombre de concentración de masa, la cual adopta el símbolo de gamma minúscula γi según el libro dorado de la IUPAC (http://goldbook.iupac.org/terms/view/M03713),
por lo que su versión porcentual la nombraremos como ppcγi.
(34)
Podemos afirmar que es una unidad dimensional, como se
relaciona a la densidad, se expresa en unidades de densidad g/ml o kg/L, es
decir cociente de unidades cortas o cociente de unidades largas, pero no se combinan,
por lo que normalmente no se expresaría kg/ml o g/L.
(35)
La versión porcentual es la que se hace molesta ya que
debemos tener en cuenta la pseudo-unidad porcentual, para el análisis
dimensional debemos tener en cuenta la presencia del porcentual y las unidades
de densidad. Es común que algunos problemas mencionan expresiones como
porcentaje masa a volumen % m-v dejando así implícito al lector la necesidad de
presentar las unidades g/ml y de eliminar el %. De lo anterior se puede
generalizar partes por volumétrico como.
(36)
Masa del soluto en términos de la concentración masa a
volumen y el volumen total.
(37)
Volumen
total en términos de la concentración masa a volumen y la masa del soluto.
(38)
Concentración de masa en términos de la masa de soluto, la masa
y la densidad totales.
(39)
Masa de soluto en términos de la concentración de masa, la
masa total y la densidad total.
(40)
Masa total en términos de la concentración de masa, la masa
de soluto y la densidad total
(41)
Densidad total en términos de la concentración de masa, la
masa de soluto y la masa total.
(42)
Calcular porcentaje en masa a volumen con la concentración
de masas, y la concentración de masas con el porcentaje masa a volumen.
(43)
(44)
Calcular partes por millón masa a volumen con la
concentración masa a volumen, y la concentración masa a volumen con partes por
millón masa a volumen.
(45)
(46)





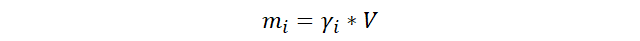


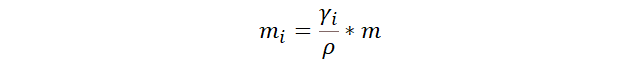




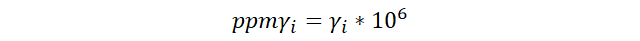


No hay comentarios:
Publicar un comentario