(Ciencias de Joseleg)
(Química) (Química cuantitativa) (Termoquímica)
(Ejercicios) (Introducción)
(Historia)
(Energía)
(Sistema,
alrededores y calor) (Primera
ley de la termodinámica) (Entalpía)
(Entalpía
de la reacción) (Capacidad
calorífica y calor específico) (Calorimetría
a volumen constante) (Calorimetría
a presión constante) (Ley
de Hess) (Entalpía
de formación) (Calor
de solución y disolución) (Termoquímica
de los alimentos) (Termoquímica
de los combustibles) (Energía
del futuro) (Referencias
bibliográficas)
El valor de ∆H se puede determinar experimentalmente midiendo el flujo de calor que acompaña a una reacción a presión constante. Por lo general, podemos determinar la magnitud del flujo de calor midiendo la magnitud del cambio de temperatura que produce el flujo de calor. La medida del flujo de calor es calorimetría; Un dispositivo utilizado para medir el flujo de calor es un calorímetro.
Cuanto más calor gana un objeto, más caliente se pone. Todas las sustancias
cambian de temperatura cuando se calientan, pero la magnitud del cambio de
temperatura producido por una cantidad dada de calor varía de una sustancia a
otra. El cambio de temperatura experimentado por un objeto cuando absorbe una
cierta cantidad de calor está determinado por su capacidad de calor, denotada C.
La capacidad de calor de un objeto es la cantidad de calor requerida para
elevar su temperatura en 1 K (o 1 °C). Cuanto mayor es la capacidad de calor,
mayor es el calor requerido para producir un aumento dado de temperatura.
Para las sustancias puras, la capacidad calorífica generalmente se da para
una cantidad específica de la sustancia.
👉 La capacidad calorífica (Ci)
(Unidades J/°C o J/K) es el límite cuando el cambio de temperatura
tiende a cero de la diferencia de calor sobre la diferencia de temperatura,
aunque en la práctica es el calor asociado a la variación de un grado de unidad
de temperatura.
👉
El calor
específico de un mol de una sustancia se llama calor específico
molar, (Cmi) (Unidades J/°C-mol o J/K-mol).
👉 El calor específico de
un gramo de una sustancia se denomina calor específico, (Csi)
(Unidades J/°C-g o J/K-g).
Los calores específicos de muchas sustancias notables se encuentran
indexadas en tablas estandarizadas, como la consignada en este enlace para metales y
metaloides.
El cambio de temperatura
Si bien una
temperatura en kelvin es en términos absolutos diferente al valor que tenemos a
la temperatura en grados Celsius, y por ende tenemos que sumar o restar los
273.15 y ajustar por medio de un factor de conversión las unidades correctas, la
cuestión es diferente cuando tenemos un cambio de temperatura ∆T. Debido a que la
magnitud de los grados Celsius y las unidades kelvin son exactamente iguales, la
diferencia entre dos temperaturas entre las dos escalas va a tener el mismo
valor, por ende la diferencia de temperaturas en grados Celsius va a ser igual
a la diferencia de temperaturas en kelvin.
Esta conversión de plumazo no es válida con la escala Fahrenheit, debido
precisamente a que la magnitud de 1 °F es diferente a la magnitud de 1 k o 1°
Celsius.
Calor absorbido o emitido
por la masa de un cuerpo
Tenga en cuenta que:
👉Enunciado: Encuentre una función que permita calcular el
calor en términos del calor específico, la masa y el cambio de temperatura //
Pulse aquí.
El calor específico, Csi, de una sustancia se puede
determinar experimentalmente midiendo el cambio de temperatura, ∆T, que
sufre una masa conocida m de la sustancia cuando gana o pierde una
cantidad específica de calor Q:
👉 Si el signo negativo para Q nos dice que esta
reacción es exotérmica.
👉 Si el signo positivo para Q nos dice que esta
reacción es endotérmica.
Un cambio de temperatura en Kelvin es igual en magnitud al cambio de
temperatura en grados Celsius. Por lo tanto, este calor específico para el agua
también se puede informar como 4.18 J/g-°C = 4.18 J/(g °C), donde la unidad se
pronuncia "Julios por gramo-grado Celsius". Debido a que los valores de
calor específicos para una sustancia dada pueden variar ligeramente con la
temperatura, la temperatura a menudo se especifica con precisión. El valor de
4.18 J / g-K que usamos aquí para el agua, por ejemplo, es para agua
inicialmente a 14.5 °C. El calor específico del agua a esta temperatura se usa
para definir las calorías al valor dado cal = 4.184 J exactamente.
Por lo tanto, podemos calcular la cantidad de calor que una sustancia gana
o pierde usando su calor específico junto con su masa medida y el cambio de
temperatura. Los calores específicos dependen directamente de la identidad y
cantidad de la sustancia, por lo que son en términos prácticos, constantes que
deben consultarse en tablas, a menos que el enunciado del ejercicio los de o
los pida.
Tabla 8‑1. Calores específicos de algunas
sustancias a 298 K.
Calor compartido por dos
cuerpos y temperatura de equilibrio
Ahora que ya sabemos calcular el calor absorbido o emitido por un solo cuerpo, abordaremos el problema de dos cuerpos que permiten el flujo de calor desde el cuerpo mas caliente al cuerpo mas frio hasta alcanzar el punto de equilibrio que corresponde a la temperatura de equilibrio. Por ende, ¿Cuál es la función que permite hallar dicha temperatura de equilibrio? La cosa es que esta pregunta implica un diseño experimental denominado calorímetro, y por ende, responderemos esta pregunta y sus consecuencias en las siguientes secciones.



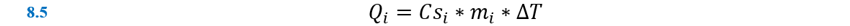


No hay comentarios:
Publicar un comentario