👉Enunciado: Una muestra de 0.1375 g de magnesio sólido se quema en un calorímetro de bomba de volumen constante que tiene una capacidad calorífica de 3024 J/°C. La temperatura aumenta en 1.126 ° C. Calcule el calor desprendido por la combustión de Mg, en kJ/g y en kJ/mol.
|| Enlace a YouTube || Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
👉Solución: Como nos preguntan por el calor estándar desprendido por un reactivo clave emplearemos las ecuaciones:
Punto (a) entalpía o
calor de la reacción estándar, que es lo mismo que decir ponderada a moles.
Recuerde que la
entalpía anterior están ponderada a 1 mol de reactivo en lugar de 1 mol de
reacción.
👉Otros
enunciados: Determine el calor de combustión de 0.1375 g Mg que aumentan la
temperatura en 1.126 °C, Determinar el calor de combustión de 0.1375 g
Mg que aumentan la temperatura en 1.126 °C, Calcule el calor de combustión de
0.1375 g Mg que aumentan la temperatura en 1.126 °C, Calcular el calor de combustión de
0.1375 g Mg que aumentan la temperatura en 1.126 °C, Halle el calor de combustión de
0.1375 g Mg que aumentan la temperatura en 1.126 °C, Hallar el calor de combustión de
0.1375 g Mg que aumentan la temperatura en 1.126 °C,
👉Temas: química, química general, Termoquímica, joseleg, calor, capacidad
calorífica, calor específico, calorímetro de presión constante




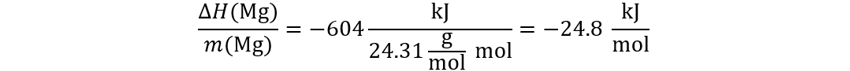

No hay comentarios:
Publicar un comentario