👉Enunciado: Considere la reacción H2(g)+Cl2(g) →2HCl(g) ∆H0 = -184.6kJ/mol Si 3 moles de H2 reaccionan con 3 moles de Cl2 para formar HCl, calcule el trabajo realizado (en julios) contra una presión de 1.0 atm a 25 ° C. ¿Qué es ∆E para esta reacción? Suponga que la reacción se completa.
|| Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-entalpia-reaccion.html
https://quimicadejoselegcuantitativa.blogspot.com/2022/02/Quimica-energia-reaccion-gases.html
👉Solución: Usamos la función para el cálculo de energía interna con las variables
de gas.
Teniendo en cuenta que la suma de números estequiométricos es 0, podemos concluir analíticamente que el trabajo de la reacción también será cero, por lo que el cambio de energía depende solo del radio de de-Donder y la entalpía estándar de la reacción. Reemplazamos.
👉Otros
enunciados: Determine ∆E de H2(g)+Cl2(g)→2HCl(g)
∆H0 = -184.6 kJ/mol si se consumen 3 mol de H2,
Determinar ∆E de H2(g)+Cl2(g)→2HCl(g) ∆H0 = -184.6 kJ/mol si se consumen 3 mol de H2,
Calcule ∆E de H2(g)+Cl2(g)→2HCl(g) ∆H0 = -184.6 kJ/mol si se consumen 3 mol de H2,
Calcular ∆E de H2(g)+Cl2(g)→2HCl(g) ∆H0 = -184.6 kJ/mol si se consumen 3 mol de H2,
Halle ∆E de H2(g)+Cl2(g)→2HCl(g) ∆H0 = -184.6 kJ/mol si se consumen 3 mol de H2,
Hallar ∆E de H2(g)+Cl2(g)→2HCl(g) ∆H0 = -184.6 kJ/mol si se consumen 3 mol de
H2,
👉Temas: química, química general, Termoquímica, joseleg, calor de reacción


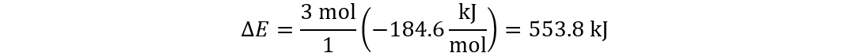

No hay comentarios:
Publicar un comentario