Mas
ejercicios resueltos de química sobre #propiedadesdelasdisoluciones. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #propiedadesdelasdisoluciones. ¡Si
te gustó, suscríbete!
👉Demostración de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/coligativas-solucion-ideal.html
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/coligativas-ley-raoult.html
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/coligativas-abulloscopico-crioscopico.html
👉Solución: Primero veremos los puntos de fusión y ebullición.
Dado que ambas son soluciones acuosas, convertimos a constantes indeterminadas todos los términos asociados al solvente.
La constante es la misma, por lo que los puntos de
fusión y ebullición depende solo de la concentración molal por el factor de van't
Hoff, para la purea que no es un electrolito ese efecto es de 1 por la
molalidad, es decir 0.90 m, pero para el CaCl2 completamente ionizado
es de 3 por la molalidad, es decir 1.05 m. Recuerde que el factor de van't Hoff
es igual al número de iones generados interpretando la ionización de manera
molecular.
👩🔬 Concluimos que el CaCl2 posee un mayor
punto de ebullición y un menor punto de fusión.
Ahora vamos a obtener el producto concentración molal
por factor van't Hoff en la ley de Raoult.
El efecto del producto factor van't Hoff por molalidad
se encuentra dividiendo a una división, por ende, su efecto es directamente proporcional,
pero a su vez como está restando a una unidad, entonces pasa a ser inversamente
proporcional, a mayor molalidad de van't Hoff del soluto menor será la presión
de vapor, por lo que nuevamente el CaCl2 posee un mayor efecto de
disminución de presión de vapor debido a su ionización completa.
👩🔬 Concluimos que el CaCl2 posee una menor presión de vapor.
👉Temas: química, química general, disoluciones, propiedades de las disoluciones, factor van't Hoff,


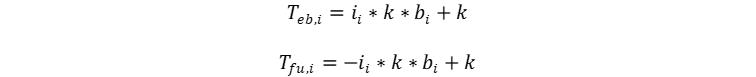


No hay comentarios:
Publicar un comentario