👉Enunciado: La solubilidad del CO2 en agua a 25 °C y 1.00 atm es 0.034 mol / L. ¿Cuál es su solubilidad en condiciones atmosféricas? (La presión parcial de CO2 en el aire es de 0.0003 atm.) Suponga que el CO2 obedece la ley de Henry.
Mas
ejercicios resueltos de química sobre #propiedadesdelasdisoluciones. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #propiedadesdelasdisoluciones. ¡Si
te gustó, suscríbete!
👉Demostración de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/coligativas-ley-henry.html
👉Solución: iniciamos
con la ley de los gases ideales en la cual asumimos que la temperatura y la
constante de los gases ideales se mantienen constantes y por lo tanto se
fusionan en una nueva constante. Posteriormente se despeja el cociente cantidad
de sustancia sobre volumen para obtener la concentración molar. Finalmente
dividimos la ecuación entre sí misma pero para los términos en el estado
inicial y despejamos la concentración final pues la asumiremos como la
solubilidad final.
Reemplazamos.
👉Otros enunciados: Determinar la
solubilidad en condiciones normales si a 0.0003 atm y 25°C es de 0.34 mol/L, Cual
es la solubilidad en condiciones normales si a 0.0003 atm y 25°C es de 0.34 mol/L,
ley de henry, como usar la ley de henry, Calcule la solubilidad en condiciones
normales si a 0.0003 atm y 25°C es de 0.34 mol/L, Calcular la solubilidad en
condiciones normales si a 0.0003 atm y 25°C es de 0.34 mol/L, Halle la
solubilidad en condiciones normales si a 0.0003 atm y 25°C es de 0.34 mol/L, Hallar
la solubilidad en condiciones normales si a 0.0003 atm y 25°C es de 0.34 mol/L,
Como calcular la solubilidad de un gas con un cambio de presiones |LEY DE
HENRY|
👉Temas: química,
química general, disoluciones, propiedades de las disoluciones, solubilidad, efecto
de la presión en la solubilidad, ley de Henry, uso de la ley de henry


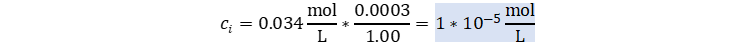

No hay comentarios:
Publicar un comentario