En física y química, la ley de conservación de la energía
establece que la energía total (E o ET) de un sistema aislado
permanece constante; se dice que se conserva con el tiempo (Feynman, Leighton, & Sands, 1965). Por ende, la energía total
inicial (E0), será igual a
la energía total final (E). Tenga en cuenta que en algunas
fuentes especialmente en termodinámica avanzada la energía termodinámica o
energía interna de un sistema se modela con el símbolo ΔU (IUPAC, 2020).
Esta ley, fue propuesta y probada por primera vez por Émilie
du Châtelet (Hagengruber, 2012), significa que la energía no se puede crear ni
destruir; más bien, solo se puede transformar o transferir de una forma a otra;
también implica necesariamente que la energía total de un sistema es igual a la
suma de las energías de los subsistemas (i) que lo componen.
Por ejemplo, la energía química se convierte en energía cinética cuando explota una barra de dinamita. Si se suman todas las formas de energía que se liberaron en la explosión, como la energía cinética y la energía potencial de las piezas, así como el calor y el sonido, se obtendrá la disminución exacta de la energía química en la combustión de la dinamita.
La energía puede manifestarse de formas diversas:
- Calor, asociada a la cantidad de vibración molecular
transferible entre dos sistemas.
- Energía cinética que está asociada a su velocidad y su
masa.
- Energía potencial que está asociada a la energía cinética
desencadenable por una atracción gravitacional.
- Energía de trabajo mecánico asociada al desplazamiento de
una masa ejercida por una fuerza.
- Energía de radiación electromagnética, la cual puede dividirse
en subcategorías como luz o calor.
- Energía química asociada a los enlaces ya sea formación o
rompimiento, sean estos débiles o fuertes de las moléculas y/o átomos.
- La energía nuclear que mantiene unidos las partículas
subatómicas al interior del núcleo atómico.
- la materia, que es una forma especial y condensada de
energía.
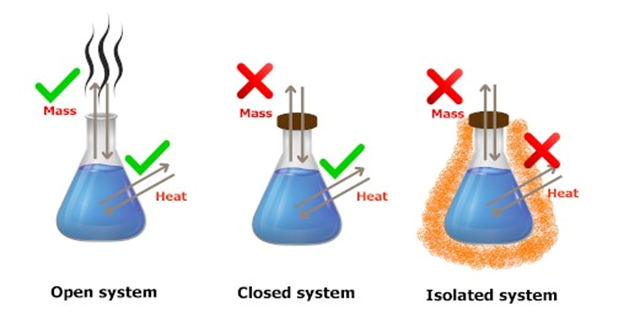
El sistema debe estar aislado (sin flujos de energía o materia con los alrededores del sistema), pues de lo contrario la ley y su modelo matemático se hacen inválidos y deben modificarse.
Figura 2‑1. Los modelos matemáticos son muy sensibles a los presupuestos
cualitativos de un sistema, si cambia la naturaleza del sistema, las
matemáticas cambian.
La masa y la energía se pueden ver como dos nombres (y dos
unidades de medida) para la misma cantidad física subyacente y conservada y
relacionada en la ecuación (ecuación 2.3.).
Por lo tanto, las leyes de conservación de la energía y
conservación de la masa (total) son equivalentes y ambas son verdaderas, cuando una no
cuadra es que no se está tomando en cuenta la otra. Einstein explicó
en un ensayo de 1946 que "el principio de la conservación de la masa resultó [...]
inadecuado frente a la teoría especial de la relatividad. Por lo tanto, se
fusionó con el principio de conservación de la energía, tal como, unos 60 años
antes, el principio de la conservación de la energía mecánica se había
combinado con el principio de la conservación del calor [energía térmica].
Podríamos decir que el principio de la conservación de la energía, habiendo
absorbido previamente el de la conservación del calor, ahora procedía a traga
eso de la conservación de la masa, y mantiene el campo solo" (Einstein,
1996).
A pesar de esto, los procesos químicos estándar no requieren
un balance combinado de materia y energía, dado que para estas reacciones la
masa no se convierte en energía de manera significativa (ecuación 2.3.),
aunque en verdad si ocurre dicha conversión en los procesos químicos que
denominamos no-nucleares, la mayoría de los instrumentos no podrían medir que algo
pasa, así que esta ley se divide en la ley de la conservación de la energía y la ley de la
conservación de la masa.
En química, la energía puede percibirse como dos cosas
diferentes,
- como un potencial de cambio químico,
- como una condición para el cambio químico;
en cualquiera de los dos, los cambios químicos o reacciones,
en las cuales las sustancias alteran sus identidades requieren de un cambio de
energía por emisión o por absorción; de allí que dividamos la energía en una reacción
química en dos categorías.
Una reacción exergónica es una reacción química donde el
cambio en la energía libre es negativo (hay una liberación neta de energía
libre), que indica una reacción espontánea. En palabras más
sencillas, los reactivos son de alta energía potencial, y cuando se altera el
sistema levemente, ocurre una reacción espontánea, muchas veces hasta violenta,
como una explosión, liberando energía al ambiente, ya sea en forma de calor,
luz, sonido, electrones entre otros. Aunque parte de esa energía puede ser
absorbida por los productos en sus nuevos enlaces, siempre existe una pérdida
de energía que se dispersará en los alrededores del sistema en forma de calor
inútil.
Aunque se dice que las reacciones exergónicas ocurren
espontáneamente, esto no implica que la reacción se llevará a cabo a una
velocidad observable. Por ejemplo, la desprotonación del peróxido de hidrógeno
es muy lenta en ausencia de un catalizador adecuado.
Las reacciones exergónicas generalmente se relacionan a la
emisión de calor, y por ende tienden a ser denominadas exotérmicas, pero el calor no es
la única forma de energía que pueden emitir, pues también pueden generar flujo
eléctrico y emisión de luz. En los sistemas vivos, una ruta encadenada de reacciones
que destruye una o varias sustancias para obtener la energía que estas
contienen se denomina como un proceso catabólico
o liberador de energía.
Una reacción endergónica es una reacción química donde el
cambio en la energía libre es positivo (hay una absorción neta de energía
libre), que indica una reacción solo será espontánea si se le proporciona energía.
En palabras más sencillas, los reactivos son de baja energía potencial, y para
que la reacción se dé, se requiere un pago energético mayor que el de los
productos, pues mucha de la energía dada será absorbida por el universo en
forma de calor inútil.
Es como si el universo fuera un gobernante corrupto que se
queda con la mayoría del dinero en TODO tramite energético en todo el universo
conocido hasta ahora. En cualquiera de los dos procesos, el universo siempre se
queda con mucha energía, por lo que solo una fracción, llamada energía libre es
la que se involucra realmente en el proceso químico.
Aunque se dice que las reacciones exergónicas no son
espontáneas, esto no implica que la reacción sea imposible o inviable. Por
ejemplo, la síntesis de ADN requiere de la liberación de la energía de los
nucleótidos trifosfatados, cuando estos pierden dos fosfatos, se libera la
energía requerida para unirlos a la cadena creciente del ADN.
Las reacciones endergónicas generalmente se relacionan a la
absorción de calor, y por ende tienden a ser denominadas endotérmicas, pero el calor no
es la única forma de energía que pueden absorber, pues también pueden requerir
flujo eléctrico y absorber ciertos colores de luz como en la fotosíntesis. En
los sistemas vivos, una ruta encadenada de reacciones que construye una o
varias sustancias para almacenar energía la energía que estas se denomina como
un proceso
anabólico o de construcción de
estructuras, que de otro modo no deberían existir.
En las reacciones biológicas, los catabolismos liberadores
de energía se conectan indirectamente con los anabolismos constructores a
través de sustancias puente que transportan la energía de un lugar a otro, en
enlaces de fosfato o en enlaces a protones ácidos, siendo estas sustancias
llamadas coenzimas portadoras de energía. Las reacciones anteriores son
bidireccionales, por lo que, dependiendo de las necesidades celulares, el
portador puede absorber o liberar la energía:
El estudio del balance energético es extenso y será ahondado
en el capítulo de termodinámica, por el momento tenga en cuenta que las
reacciones endergónicas y exergónicas se identifican mediante un nuevo
parámetro en una ecuación química, denominado calor de reacción o cambio de
entalpia.
El Calor de Reacción (también conocido como Entalpía de
Reacción) es el cambio en la entalpía de una reacción química que ocurre a
presión constante. Es una unidad termodinámica de medida útil para calcular la
cantidad de energía por mol de reacción (es decir, por avance de reacción)
liberada o producida en una reacción química. Dado que la entalpía se deriva de
la presión, el volumen y la energía interna, todas las cuales son funciones de
estado, la entalpía también es una función de estado.
Las entalpias (H)
por mismas no se pueden medir, lo que se miden son entalpias relativas a algún
punto arbitrario o de referencia, que para la mayoría de las sustancias es su
sustancia elemento. Por ejemplo, el cambio de entalpia para la formación del
aluminio metálico es 0 kJ/mol. El cambio de entalpia de la reacción (ΔH) es la medida de energía
por mol de reacción que nos servirá de pista para saber si un proceso es
alergénico o endergónico.
El cambio de entalpia de la reacción es igual a la
diferencia entre los cambios de entalpias de formación de los productos menos
los cambios de entalpias de formación de los reactivos. Es simple economía
energética.
- si los productos son más costosos que los reactivos,
debemos pagar con energía extra para formarlos, por lo que el cambio de
entalpia de la reacción será positivo, y la reacción tenderá a ser endergónica.
- si los productos son menos costosos que los reactivos,
estos pagan por si mismos la formación de productos, por lo que el cambio de
entalpia de la reacción será negativo, y la reacción tenderá a ser endergónica.
|
|
|
Como se mencionó anteriormente, ahondaremos en estos
conceptos de manera más profunda en capítulos futuros.









No hay comentarios:
Publicar un comentario