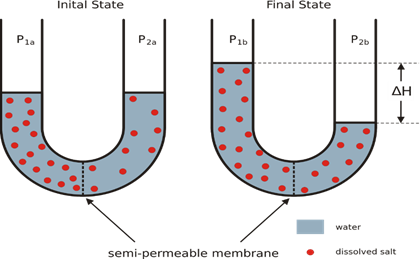
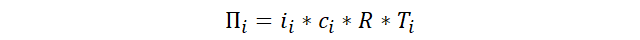(Ciencias de Joseleg) (Química) (Química cuantitativa) (Propiedades
de las disoluciones) (Ejercicios) (Introducción) (Introducción
a la solubilidad) (Electrolitos
y conductividad) (Factores
que afectan la solubilidad) (Solubilidad
a nivel molecular) (Modelo
matemático de la solubilidad) (La
solución ideal y el factor de van't Hoff)
(La
ley de Henry) (Presión
de vapor) (La
ley de Raoult) (Diagramas
de fase) (Aumento
ebulloscópico y descenso crioscópico)
(Propiedades
coligativas de la atmósfera) (Ósmosis) (Coloides) (Referencias
bibliográficas)
Administration du grand dictionnaire universel. (1866). atome s. m. (phys.). Retrieved November 21, 2019, from https://fr.wikisource.org/wiki/Grand_dictionnaire_universel_du_XIXe_siècle/atome_s._m._(phys.)
Brady, J. E., & Humiston, G. E.
(1986). General Chemistry: Principles and Structure. Wiley & Sons.
Brown, T. L., LeMay, H. E. J.,
Bursten, B. E., Murphy, C. J., & Woodward, P. (2009). Chemistry the
central science (11th ed.). Pearson; Prentice Hall.
Brown, T. L., LeMay, H. E. J.,
Bursten, B. E., Murphy, C. J., Woodward, P. M., & Stoltzfus, M. W. (2017). Chemistry,
the central science (13th ed.). Boston: Pearson.
Brown, T. L., LeMay, H. E. J.,
Bursten, B. E., Murphy, C. J., Woodward, P., & Stoltzfus, M. W. (2015). Chemistry
the Central Science.
Chang, R. (2006). Chang’s “General
Chemistry - Essential Concepts” (4th ed.). McGraw-Hill New York.
Chang, R. (2010). Chemistry
(10th ed.). McGraw-Hill New York.
Chang, R., & Overby, J. (2011). General
Chemistry,Th e Essential Concepts (11th ed.). McGraw-Hill New York.
Dalton, J. (2010). A new system of
chemical philosophy (Vol. 1). Cambridge University Press.
Ebbing, D. D., & Gammon, S. D.
(2008). General chemistry. (Houghton Mifflin Company, Ed.) (9th ed.).
Bonston.
Felder, R. M., Rousseau, R. W., &
Bullard, L. G. (2020). Elementary principles of chemical processes. John Wiley & Sons.
García-García,
J. L. (2021). Deduciendo las relaciones entre las unidades de concentración en
disoluciones líquidas. Educación Química, 32(3), 38–51.
Gilbert, T. R.,
Kirss, R. V, Foster, N., & Davies, G. (2012). Chemistry, the science in context (3rd ed.). W. W. Norton &
Company, Inc.
Gorzynski, J. (2010). General,
organic, and biological chemistry (1st ed.). McGraw-Hill Education.
IUPAC. (2019). Compendium of
Chemical Terminology the “Gold Book.” (S. J. Chalk, Ed.) (2nd ed.).
Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications,
Oxford. Retrieved from http://goldbook.iupac.org/
Jespersen, N. D., Brady, J. E., &
Hyslop, A. (2012). Chemistry The Molecular Nature of Matter (6th ed.).
USA: Wiley.
Laing, M. (1996). Bring back
equivalent weight - If you want the kids to “think”! Journal of Chemical
Education, 73(11), 1007–1012. https://doi.org/10.1021/ed073p1007
Lewis, G. N., & Randall, M.
(1923). Thermodynamics and the free energy of chemical substances. McGraw-Hill.
Matamála, M.,
& Gonzalez, P. (1976). Química General. Cultural.
Mohr, F.
(1855). Lehrbuch der
chemisch-analytischen Titrirmethode; Vieweg und Sohn: Braunschweig,. Retrieved from
https://play.google.com/store/books/details?id=KYpZAAAAYAAJ&rdid=book-KYpZAAAAYAAJ&rdot=1
Ohimain, E. I. (2016). Methanol
contamination in traditionally fermented alcoholic beverages: the microbial
dimension. SpringerPlus, 5(1), 1607.
Petrucci, R. H., Harwood, W. S.,
& Herring, F. G. (2003). Química General (8th ed.). Prentice Hall.
Petrucci, R. H., Herring, F. G.,
Madura, J. D., & Bissonnette, C. (2010). General Chemistry Principles
and Modern Applications (10th ed.). Pearson.
Raymond, K. W. (2014). General,
Organic, and Biological Chemistry, an Integrated Aproach (4th ed.). Wiley.
Richter, J. B. (1792). Anfangsgründe
der Stöchiometrie: oder, Messkunst chemischer Elemente. (Johann Friedrich
Korn der Aeltere, Ed.). Germany: Breslau and Hirschberg. Retrieved from
https://books.google.com.co/books?id=NhFQAAAAcAAJ&pg=PR1&redir_esc=y#v=onepage&q&f=false
Rocke, A. J. (1984). Chemical
atomism in the nineteenth century: from Dalton to Cannizzaro. Ohio State
University Press.
Silberberg, M. S. (2009). Chemistry,
The Molecular Nature of Matter and Change (5th ed.). McGraw-Hill Education.
Timberlake, K. C. (2015). Chemistry
An Introduction to General, Organic, and Biological Chemistry (15th ed.).
USA: Pearson.
Wenzel, C. F. (1777). Lehre von der
Verwandtschaft der Körper [Theory of the Affinity of Bodies (i.e., substances)]
(in German). Dreßden, (Germany): Gotthelf August Gerlach.
Whitten, K. W., Davis, R. E., Peck,
M. L., & Stanley, G. G. (2010). Chemistry (9th ed.). Brooks/Cole.
Wilhelm, S. (1989). Der
historische Weg der Chemie. Aulis Verlag Deubner & Co KG, Köln.
Wurtz, C. A. (1860). Account of the
Sessions of the International Congress of Chemists in Karlsruhe, on 3, 4, and
5. Retrieved November 21, 2019, from
http://web.lemoyne.edu/~GIUNTA/karlsruhe.html
Zeising, A. (1856). Das
Normalverhältnis der chemischen und morphologischen Proportionen; Weigel.
Retrieved from https://archive.org/details/bub_gb_n8g6AAAAcAAJ/page/n99
Zumdahl, S. S.,
& Zumdahl, S. A. (2007). Chemistry (7th ed.). Boston: Houghton Mifflin Company.
Zumdahl, S. S.,
Zumdahl, S. A., & DeCoste, D. J. (2018). Chemistry (10th ed.). Cengage Learning.