👉 𝑬𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐: Determine la cantidad de calor (en kJ) que se desprende cuando se producen 1.26 x 104 g de amoníaco de acuerdo con la ecuación N2(g) + 3H2(g) → 2NH3(g) ∆H°rxn = -92.6 kJ/mol. Suponga que la reacción tiene lugar en condiciones de estado estándar a 25°C.
|| Enlace a YouTube || Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉 𝑫𝒆𝒎𝒐𝒔𝒕𝒓𝒂𝒄𝒊𝒐𝒏𝒆𝒔 𝒚/𝒐 𝒄𝒐𝒏𝒄𝒆𝒑𝒕𝒐𝒔 𝒕𝒆ó𝒓𝒊𝒄𝒐𝒔:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-entalpia-reaccion.html
https://quimicadejoselegcuantitativa.blogspot.com/2022/02/Quimica-estandar-molar-especifica.html
👉 𝑺𝒐𝒍𝒖𝒄𝒊ó𝒏: emplearemos la función que relaciona la entalpía de la reacción en términos de la entalpía estándar de la reacción y el avance de la reacción para una reacción química no reversible o cuya reversibilidad es despreciable. Tenga en cuenta que la masa molar del amoníaco es (17.03 g/mol).
👉 𝑶𝒕𝒓𝒐𝒔 𝒆𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐𝒔: Determine el calor (en kJ) que
se desprende cuando se producen 1.26 x 104 g de amoníaco, Determine el
calor (en kJ) que se desprende cuando se producen, Determine el calor (en kJ)
que se desprende, determinar la entalpía de la reacción, Calcular el calor de formación
de 1.26*10(4) gramos de amoníaco, calor de formación de 1.26*10+4 gramos de
amoníaco, calor de formación de 1.26*104 gramos de NH3 en kJ
👉 𝑻𝒆𝒎𝒂𝒔: química, química general, Termoquímica,
joseleg, calor, entalpía, entalpía de la reacción, entalpía estándar de la
reacción, entalpía específica para una sustancia en la reacción, avance de la
reacción, ley de hess ejemplos, ley de hess ejercicios, ley de hess ejercicios
resueltos, ley de hess definición, ejercicios ley de Hess, entalpia termodinámica,
ejercicios de entalpía resueltos, ejercicios de entalpia

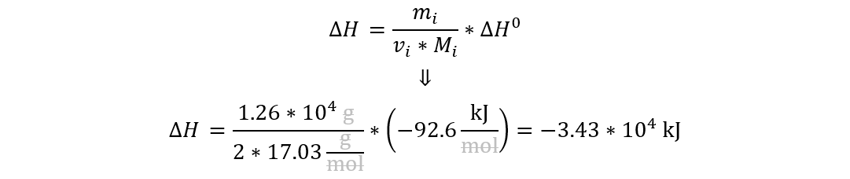

No hay comentarios:
Publicar un comentario