👉Enunciado: Calcule los calores de combustión para 2H2(g)+O2(g)→2H2O(l) a partir de las entalpías estándar de formación.
|| Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-entalpia-formacion.html
👉Solución: Aplicamos la ley de Hess.
Teniendo en cuenta que las respectivas ∆Hf°
son (0), (0), (-285.8 kJ/mol)
👉Otros
enunciados: Determine el ∆H° para 2H2(g)+O2(g)→2H2O(l),
Determinar el ∆H° para 2H2(g)+O2(g)→2H2O(l),
Calcule el ∆H° para 2H2(g)+O2(g)→2H2O(l),
Calcular el ∆H° para 2H2(g)+O2(g)→2H2O(l),
Halle el ∆H° para 2H2(g)+O2(g)→2H2O(l),
Hallar el ∆H° para 2H2(g)+O2(g)→2H2O(l),
👉Temas: química, química general, Termoquímica, joseleg, calor, capacidad
calorífica, calor específico, entalpía estándar de formación, ley de Hess


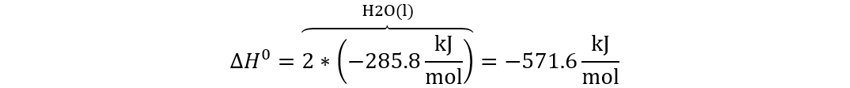

No hay comentarios:
Publicar un comentario