👉Enunciado: Calcule el calor de descomposición para este proceso a presión constante y 25 ° C: CaCO3(s)→CaO(s)+CO2(g).
|| Enlace a YouTube || Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-ley-hess.html
👉Solución: Aplicamos la ley de Hess
Al corporizar la ecuación, pondremos las identidades sobre los
términos. Adicionalmente, tenga en cuenta que todos los coeficientes
estequiométricos en esta reacción valen 1, por lo que los cancelamos implícitamente.
Aunque este paso no es necesario, si que ayuda a entender como reemplazar.
Pero para
usarla, necesitamos las entalpías de formación de las tres sustancias:
https://en.wikipedia.org/wiki/Standard_enthalpy_of_formation
Que en su
orden son (−1206.9 kJ/mol), (−635.09 kJ/mol), (−393.509 kJ/mol). Reemplazamos.
👉Otros
enunciados: Determine el calor de descomposición de
CaCO3(s)→CaO(s)+CO2(g), Determinar el calor de
descomposición de CaCO3(s)→CaO(s)+CO2(g), Calcule el
calor de descomposición de CaCO3(s)→CaO(s)+CO2(g),
Calcular el calor de descomposición de CaCO3(s)→CaO(s)+CO2(g),
Halle el calor de descomposición de CaCO3(s)→CaO(s)+CO2(g),
Hallar el calor de descomposición de CaCO3(s)→CaO(s)+CO2(g),
👉Temas: química, química general, Termoquímica, joseleg, calor, capacidad
calorífica, calor específico, entalpía estándar de formación, ley de Hess



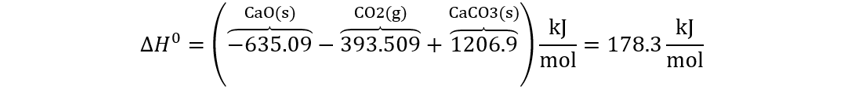

No hay comentarios:
Publicar un comentario