👉Enunciado: Sugiera formas (con ecuaciones apropiadas) que le permitirían medir los valores ∆Hf° de Ag2O(s) y CaCl2(s) a partir de sus elementos. No son necesarios cálculos.
|| Enlace a YouTube || Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-entalpia-formacion.html
https://quimicadejoselegcuantitativa.blogspot.com/2022/02/Quimica-ley-Hess-mol-gramo.html
👉Solución: Las dos sustancias pueden sintetizarse a partir de las formas
fundamentales de los elementos que los componen. En ambos casos tendríamos que
los reactivos, al ser estados fundamentales, tendrían entalpías de formación
cero, y solo tendríamos un producto.
Experimentalmente
hablando, uno no mide una entalpía estándar, a menos que conscientemente
ajustemos la cantidad de sustancia del producto clave para que represente 1 mol
de avance de la reacción, de lo contrario, lo que medimos son entalpías a
secas, no estándares. Recuerde que la entalpía estándar y la entalpía no
estándar se relacionan por medio del radio de de-Donder. Pero dicho radio nos
introduce otro problema, ¿cual es la sustancia de análisis?
Por diseño
experimental es mas sencillo usar como sustancia de análisis el reactivo
limitante, dado que en calor de formación de ambos reactivos es cero, por lo
que usaremos al calcio como reactivo limitante al ser mas fácil medir la masa
de un sólido. En el modelo lo introducimos como el reactivo clave (r).
Si
reemplazamos:
La
entalpía de la reacción se puede calcular por medio de un calorímetro de bomba,
cuya ecuación base es:
Igualamos
ambas expresiones.
Evidentemente
esta es una solución muy diferente que la que ofrece un libro de texto, por lo
que la única forma de saber si estamos en lo correcto es evaluar datos
verdaderos, por suerte internet es grande y encontré un enunciado con datos
para una de las dos reacciones implicadas.
(Problema
4 https://www.crestwoodschools.org/userfiles/867/Classes/9260/lots%20of%20calorimetry%20problems.pdf?id=23403)
Un calorímetro particular contiene 3.54 kg de agua, cuando 8.36 g de calcio reaccionan con exceso de cloro en este calorímetro, la temperatura aumenta 11.2 K. Este enunciado nos permite inferir que estamos trabajando con un calorímetro de bomba por una razón simple, en un calorímetro de taza de café no podríamos aislar al calcio u al dicloro del agua, y estos reaccionarían primero con el agua y no entre ellos. Dicho esto, la capacidad calorífica del calorímetro se deberá calcular con la definición de calor específico para el agua, que simbolizaremos como (d).
Y reemplazamos en la
fórmula de entalpía estándar de formación.
La ecuación química balanceada:
Dado que sabemos que el calor específico del agua es 4.184 J/g-K y la masa molar del calcio metálico es calcio 40.10 g/mol, debería ser posible calcular su entalpía estándar de formación.
Si buscamos en la tabla de entalpías de formación nos daremos cuanta que el valor para el sólido es -795.8 kJ/mol, bastante cercano a nuestro cálculo, lo cual demuestra que nuestra fórmula, aunque es mas compleja si es un modelo ajustado para calcular la entalpía de formación a partir de un diseño experimental verdadero.
👉Otros
enunciados: Como hacer un diseño experimental para
hallar la entalpía estándar de formación,
👉Temas: química, química general, Termoquímica, joseleg, calor, capacidad
calorífica, calor específico, entalpía estándar de formación, ley de Hess






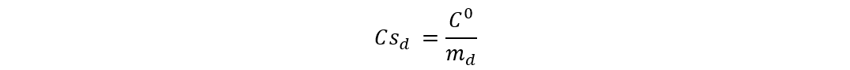




No hay comentarios:
Publicar un comentario