👉Enunciado: ¿Cuál es la cantidad más negativa a 25 °C ∆H°f para H2O (l) o ∆H°f para H2O (g)?
|| Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-entalpia-formacion.html
👉Solución: Para la reacción de vaporización se requiere de energía, por lo que
estamos hablando de un proceso endotérmico.
Si usamos la ley de
Hess, para la vaporización, la púnica manera en que la entalpía de la reacción
sea positiva para un proceso endotérmico es que la entalpía de formación del
líquido tenga un valor mas alto que el del gas.
Por lo tanto,
concluimos que el líquido tiene una entalpía estándar de formación mas negativa
que la del gas,
👉Otros
enunciados: Determine analíticamente cual estado del agua tiene un ∆H°f más negativo, Determinar
analíticamente cual estado del agua tiene un ∆H°f más
negativo, Obtenga
analíticamente cual estado del agua tiene un ∆H°f más
negativo, Obtener
analíticamente cual estado del agua tiene un ∆H°f más
negativo, Halle
analíticamente cual estado del agua tiene un ∆H°f más
negativo, Hallar
analíticamente cual estado del agua tiene un ∆H°f más
negativo,
👉Temas: química, química general, Termoquímica, joseleg, calor, capacidad
calorífica, calor específico, entalpía estándar de formación, ley de Hess


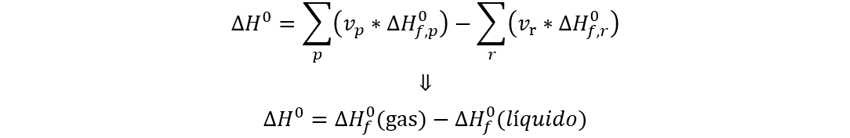

No hay comentarios:
Publicar un comentario