👉Enunciado: Se quemó una cantidad de 1.435 g de naftaleno (C10H8), una sustancia de olor acre que se usa en repelentes de polillas, en un calorímetro de bomba de volumen constante. En consecuencia, la temperatura del agua se elevó de 20.28 °C a 25.95 °C. Si la capacidad calorífica de la bomba más agua fue de 10.17 kJ / °C, calcule el calor de combustión del naftaleno sobre una base molar; es decir, encuentre el calor molar de combustión..
|| Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
👉Solución: Usaremos nuestra definición de entalpía estándar de la reacción en
términos de la capacidad calorífica del calorímetro. Luego reemplazamos
cantidad de sustancia por el cociente masa sobre la masa molar.
Calculamos
la masa molar del reactivo clave.
Reemplazamos.
👉Otros
enunciados: Determine la entalpía estándar de la
combustión de 1.435 g de naftaleno en un calorímetro de bomba Determinar la
entalpía estándar de la combustión de 1.435 g de naftaleno en un calorímetro de
bomba, Calcule la entalpía estándar de la combustión de 1.435 g de naftaleno en
un calorímetro de bomba, Calcular la entalpía estándar de la combustión de
1.435 g de naftaleno en un calorímetro de bomba, Halle la entalpía estándar de
la combustión de 1.435 g de naftaleno en un calorímetro de bomba, Hallar la
entalpía estándar de la combustión de 1.435 g de naftaleno en un calorímetro de
bomba,
👉Temas: química, química general, Termoquímica, termoquímica, joseleg


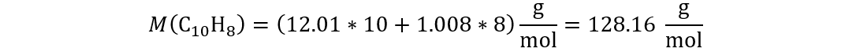


No hay comentarios:
Publicar un comentario