👉Enunciado: La presión de vapor de etanol (C2H5OH) a 20 °C es de 44 mmHg, y la presión de vapor de metanol (CH3OH) a la misma temperatura es de 94 mmHg. Se prepara una mezcla de 30.0 g de metanol y 45.0 g de etanol (y se puede suponer que se comporta como una solución ideal). (a) Calcule la presión de vapor de metanol y etanol por encima de esta solución a 20 ° C. (b) Calcule la fracción molar de metanol y etanol en el vapor por encima de esta solución a 20 ° C. (c) Sugiera un método para separar los dos componentes de la solución.
Mas
ejercicios resueltos de química sobre #propiedadesdelasdisoluciones. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #propiedadesdelasdisoluciones. ¡Si
te gustó, suscríbete!
👉Demostración de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/coligativas-ley-raoult.html
👉Solución: Tomamos la
definición de fracción molar, simplificamos el cociente y reemplazamos cantidad
de sustancia por el cociente masa sobre masa molar.
Y en una mezcla con solo dos sustancias, la fracción molar recíproca
puede obtenerse como:
Luego solo es aplicar la ley de Raoult.
🔎 Respondemos primero el punto b, asumiendo que la masa molar de etanol es de 46.07 g/mol y la del metanol 32.04 g/mol, y que la sustancia (i) es metanol.
🔎 punto a,
🔎 punto c, las dos sustancias pueden separarse por destilación fraccionada.
👉Otros enunciados: Cuales son las
presiones de parciales de C2H5OH al 0.3 fracción molar en C3H7OH,
Determine las presiones de parciales de C2H5OH al 0.3 fracción molar en C3H7OH,
Determinar las presiones de parciales de C2H5OH al 0.3 fracción molar en C3H7OH,
Calcule las presiones de parciales de C2H5OH al 0.3 fracción molar en C3H7OH,
Calcular las presiones de parciales de C2H5OH al 0.3 fracción molar en C3H7OH,
Halle las presiones de parciales de C2H5OH al 0.3 fracción molar en C3H7OH,
Hallar las presiones de parciales de C2H5OH al 0.3 fracción molar en C3H7OH,
👉Temas: química,
química general, disoluciones, propiedades de las disoluciones, solubilidad, efecto
de la presión en la solubilidad, ley de Raoult, uso de la ley de Raoult





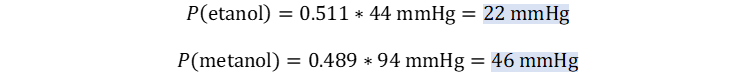

No hay comentarios:
Publicar un comentario