Enunciado ¿Cuantos iones de H+ están presentes en 10 ml de HCl al 0.01 M? Enlace a YouTube
Mas ejercicios resueltos de química
sobre #unidadesdeconcentracion. Mas ejercicios resueltos de otros
capítulos de #química. Curso de #unidadesdeconcentración. ¡Si
te gustó, suscríbete!
Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/unidades-concentracion-molaridad.html
https://quimicadejoseleg-lamateria.blogspot.com/2021/06/del-mol-la-cantidad-de-sustancia.html
Solución:
Tomamos la definición de masa molar (y
asumiremos que la molaridad de HCl es igual a la de su ion, pues el HCl es un
ácido fuerte que se disocia completamente en agua), reemplazamos cantidad de
sustancia por el cociente número de partículas sobre número de Avogadro, y
despejamos el número de partículas.
Reemplazamos
teniendo en cuenta que molar debe usarse en sus unidades fundamentales mol/L; y
mili es igual a 10-3.
Otros
enunciados: número
de iones H+ presentes en 10 ml de HCl al 0.01 M, número de iones H+ con en 10
ml de HCl al 0.01 molar, número de iones H+ con en 10 ml de HCl al 0.01 mol/L, en
10 ml de HCl al 0.01 M hallar el número de iones H+, con en 10 ml de HCl al
0.01 molar calcular el número de iones H+, con en 10 ml de HCl al 0.01 mol/L
obtener el número de iones H+
Temas: química, química general, unidades de
concentración, conversiones entre unidades de concentración, concentración
molar, molar, molaridad, número de iones, ley de Avogadro, número de Avogadro



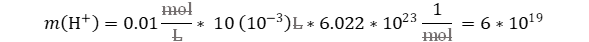

No hay comentarios:
Publicar un comentario