👉Enunciado Calcular la densidad total en g/ml de una solución de HNO3 al 16.2 normal y porcentaje en peso de 72.0 %. Enlace a YouTube
Mas
ejercicios resueltos de química sobre #unidadesdeconcentracion. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #unidadesdeconcentración. ¡Si
te gustó, suscríbete!
👉Demostración de las ecuaciones clave:
👉Solución: Usamos la solución analítica del ejercicio 10.22a3, y despejamos la densidad total.
El HNO3 posee un solo hidrógeno ionizable, por lo que asumiremos que su
equivalente molar es de 1
eq/mol. Su masa molar ya
la calculamos en este otro ejemplo con un valor de 63.02 g/mol. Reemplazamos teniendo en cuenta
que 1 litro equivale a 103 ml, se y que normal no sirve para hacer
análisis dimensional por lo que reemplazamos por sus unidades fundamentales.
👉Otros enunciados: Cual es la densidad
g/ml total de HNO3 al 16.2 normal y porcentaje en peso de 72.0%, Determine la
densidad g/ml total de HNO3 al 16.2 normal y porcentaje en peso de 72.0%,
Determinar la densidad g/ml total de HNO3 al 16.2 normal y porcentaje en peso
de 72.0%, Obtenga la densidad g/ml total de HNO3 al 16.2 normal y porcentaje en
peso de 72.0%, Obtener la densidad g/ml total de HNO3 al 16.2 normal y
porcentaje en peso de 72.0%, Calcule la densidad g/ml total de HNO3 al 16.2
normal y porcentaje en peso de 72.0%, Calcular la densidad g/ml total de HNO3
al 16.2 normal y porcentaje en peso de 72.0%, Halle la densidad g/ml total de
HNO3 al 16.2 normal y porcentaje en peso de 72.0%, Hallar la densidad g/ml
total de HNO3 al 16.2 normal y porcentaje en peso de 72.0%,
👉Temas: química, química general, unidades de
concentración, conversiones entre unidades de concentración,
concentración normal, molaridad, normalidad, densidad, porcentaje en peso


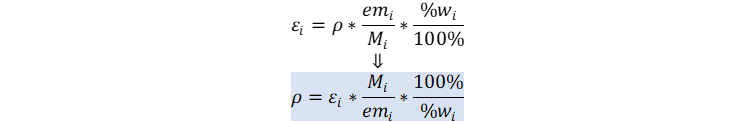
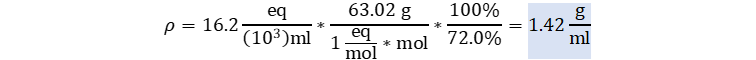

No hay comentarios:
Publicar un comentario