Enunciado Un ácido sulfúrico comercial lleva la siguiente etiqueta 49.0% y densidad 1.40. Calcule para un litro los gramos de agua teniendo en cuenta que la masa de ácido puro fue previamente calculada como 686 g. Enlace a YouTube
Mas
ejercicios resueltos de química sobre #unidadesdeconcentracion. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #unidadesdeconcentración. ¡Si
te gustó, suscríbete!
Demostración
de las ecuaciones clave:
Solución:
Asumimos la ley de la conservación de la masa, despejamos la masa del solvente y expresamos la masa total como el
producto de la densidad total por el volumen total.
Reemplazamos teniendo en cuenta que el
prefijo mili equivale a 10-3.
Otros
enunciados: sacar la
masa de agua con 686 g H2SO4 y densidad total 1.40 g/ml, cual es el peso de
agua con 686 g H2SO4 y densidad total 1.40 g/ml, obtener el peso de agua con
686 g H2SO4 y densidad total 1.40 g/ml, cuantos gramos de agua hay con 686 g H2SO4
y densidad total 1.40 g/ml, calcular la masa de agua con 686 g H2SO4 y densidad
total 1.40 g/ml, Hallar los gramos de agua con 686 g H2SO4 y densidad total 1.40
g/ml
Temas: química, química general, unidades de
concentración, conversiones entre unidades de concentración, porcentaje en
peso, densidad



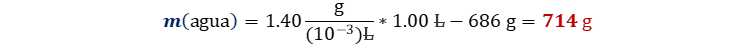

No hay comentarios:
Publicar un comentario