👉Enunciado: ¿Al mezclar las soluciones de cloruro de bario BaCl2 con sulfato de potasio K2SO4 se obtendrá algún precipitado? Escribir la ecuación química neta.
Mas
ejercicios resueltos de química sobre #propiedadesdelas disoluciones. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #propiedadesdelasdisoluciones. ¡Si
te gustó, suscríbete!
👉Demostración de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/solubilidad-factores.html
👉Solución: planteamos
la ecuación química de doble desplazamiento en la cual el polo positivo de una
sustancia se va con el polo negativo de la otra sustancia. Posteriormente
realizamos el balance de masa y determinamos cuál de los productos es insoluble
buscando en las reglas que afectan a la solubilidad con el enlace que dimos en
la parte anterior. Finalmente plantearemos la ecuación iónica neta, tomando en
cuenta únicamente el producto que es insoluble y los iones que funcionan como
sus reactivos. Tenga en cuenta que el enunciado nos dice que los 2 reactivos se
encuentran en solución por lo tanto asumiremos que están acuosos.
👩🔬 la mayoría de los cloruros son solubles
y el cloruro de potasio no es una excepción. Por otro lado, aunque la mayoría
de los sulfatos son solubles el sulfato de bario es una de las excepciones, por
lo que la sustancia que
precipita es el sulfato de bario. Por ende, escribiremos la ecuación
iónica neta como si fuera la síntesis iónica del sulfato de bario sólido:
👉Otros enunciados: Cual es la ecuación iónica
neta de la reacción de BaCl2 con K2SO4, Proponga la ecuación iónica neta de la
reacción de BaCl2 con K2SO4, Proponer la ecuación iónica neta de la reacción de
BaCl2 con K2SO4, Determine la ecuación iónica neta de la reacción de BaCl2 con
K2SO4, Determinar la ecuación iónica neta de la reacción de BaCl2 con K2SO4, Halle
la ecuación iónica neta de la reacción de BaCl2 con K2SO4, Hallar la ecuación iónica
neta de la reacción de BaCl2 con K2SO4,
👉Temas: química,
química general, disoluciones, propiedades de las disoluciones, solubilidad,
reglas de solubilidad, ecuaciones de doble desplazamiento


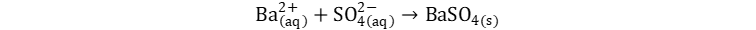

No hay comentarios:
Publicar un comentario