👉Enunciado: La densidad de una solución acuosa que contiene 10.0 por ciento de etanol (C2H5OH) en masa es 0.984 g / mL. Calcule la molalidad de esta solución.
Mas
ejercicios resueltos de química sobre #unidadesdeconcentracion. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #unidadesdeconcentración. ¡Si te
gustó, suscríbete!
👉Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/unidades-concentracion-conversiones.html
👉Solución: Usaremos la conversión de fracción de masas a molalidad dada en este enlace.
La fracción de masas es igual a dividir el porcentaje en masa entre 100% por lo tanto su valor para este caso es de wi = 0.100. Calculamos la masa molar del soluto.
Reemplazamos mili por 10-3.
👉Otros
enunciados: Cual es la molaridad de etanol al 10% y densidad 0.984 g/mL, Obtenga la
molaridad de etanol al 10% y densidad 0.984
g/mL, Obtener la molaridad de etanol al 10% y densidad 0.984 g/mL, Determine la molaridad de etanol al 10% y densidad 0.984 g/mL, Determinar
la molaridad de etanol al 10% y densidad 0.984
g/mL, Calcule la molaridad de etanol al 10% y densidad 0.984 g/mL, Calcular la molaridad de etanol al 10% y densidad 0.984 g/mL, Halle la molaridad
de etanol al 10% y densidad 0.984
g/mL, Hallar la molaridad de etanol al 10% y densidad 0.984 g/mL,
👉Temas: química, química general, disoluciones, unidades de concentración, molaridad,
concentración molar, mol/L



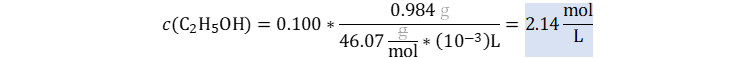

No hay comentarios:
Publicar un comentario