Mas
ejercicios resueltos de química sobre #estequiometría:
Mas
ejercicios resueltos de otros capítulos de #química:
https://cienciasdejoseleg.blogspot.com/2021/09/problemas-de-quimica-resueltos.html
Curso de
#estequiometría-analítica:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/estequiometria-analitica.html
Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/estequiometria-nueva.html
Solución:
Necesitaremos tres ecuaciones clave, la ecuación de Rl para identificar el reactivo limitante (expresada para masas), la ecuación de estequiometría gramo a gramo para calcular el rendimiento teórico y la ecuación de eficiencia de la reacción.
Necesitaremos las masas molares de los dos reactivos y del producto clave.
Primero identificamos quien es el reactivo limitante con la ecuación de Rl:
Como el resultado es negativo asumimos que el N2 está en exceso, y calcularemos la masa teórica del producto clave con el reactivo limitante.
Y con este valor calculamos el porcentaje de eficiencia.






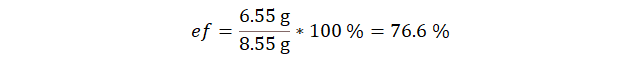

No hay comentarios:
Publicar un comentario