Enunciado: (Química-Chang13-ejemplo-3.17) El titanio es un metal fuerte, ligero y resistente a la corrosión, que se utiliza en la construcción de naves espaciales, aviones, motores para aviones y armazones de bicicletas. Se obtiene por la reacción de cloruro de titanio(IV) con magnesio fundido entre 950 y 1 1508C:
TiCl4(g) +
2Mg(l) → Ti(s) + 2MgCl2(l)
Mas
ejercicios resueltos de química sobre estequiometría:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/ejercicios-problemas-estequiometria-resueltos.html
Mas
ejercicios resueltos de otros capítulos de química:
https://cienciasdejoseleg.blogspot.com/2021/09/problemas-de-quimica-resueltos.html
Blog de
teoría:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/estequiometria-analitica.html
Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/estequiometria-nueva.html
Para ver directo en YouTube: https://youtu.be/VoqJ1eJb568
Solución:
Primero
determinaremos quien es el reactivo limitante empleando la de Rl que
usamos en el ejemplo 3.15.
Luego
calcularemos la masa de titanio que debería producirse con la ecuación de estequiometría
mol a mol. En este caso específico la incógnita es la sustancia producto a
nivel teórico
Luego
aplicaremos la ecuación de eficiencia de la reacción.
Para
poder usar las ecuaciones necesitaremos las masas molares de los dos reactivos
y del producto clave.
Reemplazamos en las fórmulas:
(a) identificar el reactivo limitante:
Como el resultado es negativo, asumimos que el
magnesio está en exceso, por lo que la estequiometría se hace con el reactivo
limitante que es el tetracloruro de titanio.
(b)
calculamos la cantidad teórica del producto clave con los datos del reactivo
limitante:
(c)
calculamos la eficiencia de la reacción:






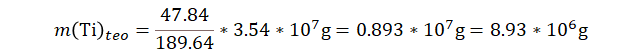


No hay comentarios:
Publicar un comentario