Para ver directo en YouTube: https://youtu.be/L2oDdZ50-Ho
Como
calcular los gramos de una sustancia con su masa molar y su número de moles,
tenga en cuenta que en este caso no hay una reacción química involucrada. Estequiometría química.
Enunciado completo del ejercicio de estequiometria:
Si un mol de NaCl pesa
58.4 gramos ¿Cuántos gramos pesan 0.5 moles de NaCl?
- Usar la definición de la masa molar.
- Despejar la masa.
- Usamos la masa molar como 58.4 g/mol y la
cantidad de sustancia como 0.500 mol.
- Concluímos que hay 29.2 g de NaCl.
Suscríbete a nuestro
canal
#cienciasdejoseleg: https://www.youtube.com/channel/UCoHZZK6xQl_NxIndVdeFgSw?sub_confirmation=1
No olviden consultar
nuestro web “https://quimicadejoselegcuantitativa.blogspot.com/2021/08/estequiometria.html” parte de nuestra serie de blogs de #cienciasdejoseleg,
donde encontrarán:
Fundamentos teóricos y
referencias bibliográficas de estequiometría analítica:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/estequiometria.html
Mas ejercicios resueltos
de química sobre la estequiometría analítica:
Litas de
reproducción
Teoría de química de
gases
https://www.youtube.com/watch?v=inKrsI1Q62M&list=PL6Meh2AYBnRRPLxFTi8NEhiEHBU41GJYx
Ejercicios de química
de gases
https://www.youtube.com/watch?v=v-DWhpx3GUM&list=PL6Meh2AYBnRQAcpspGaVZ9f6pxFIaeNtE
Teoría atómica clásica
https://www.youtube.com/watch?v=fzmZsq9g0Mo&list=PL6Meh2AYBnRRw6jH4G05yNO1tikzvhRlX
Ejercicios de teoría
atómica clásica
https://www.youtube.com/watch?v=BIfu580WyXs&list=PL6Meh2AYBnRS_JaSplKJ1EHQ6xyEg8ApS
Teoría de estequiometría
https://www.youtube.com/watch?v=1gl27UWBY7A&list=PL6Meh2AYBnRRD0snAxc6HmyI1KTviZrk8
Ejercicios resueltos
de estequiometría
https://www.youtube.com/watch?v=RIclbdX0hPs&list=PL6Meh2AYBnRTwQsL2AGlXoL1d9eS3cOfi
Teoría de disoluciones
https://www.youtube.com/watch?v=hfUROJ11ykE&list=PL6Meh2AYBnRSpJ0h0gdmZWXYeTONl5Q-L
Ejercicios resueltos
de disoluciones
https://www.youtube.com/watch?v=Yt7jK_uvn9U&list=PL6Meh2AYBnRQZJ1Pt-lA162YT4u3sjY4R

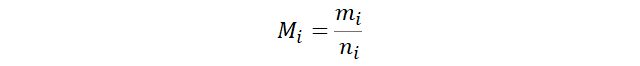



No hay comentarios:
Publicar un comentario