👉Enunciado: Balancear MnO2 + HCl → MnCl2 + Cl2 + H2O por el método del número de oxidación, también llamado de oxidación-reducción o redox.
|| Enlace a YouTube || Mas
ejercicios de balance || Ejercicios
de otros capítulos || Curso
de balance de masa y carga || ¡Si
te gustó, suscríbete! ||
👉Demostración de las ecuaciones clave o
conceptos clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/balanceo-quimico-redox.html
👉Solución: Lo primero es adjudicar
coeficientes indeterminados y encontrar los elementos que cambian de estado de
oxidación.
Dado que existen unos cloros que no cambian de estado de oxidación, es conveniente tenerlos en cuenta, pues de lo contrario el balance de masa será incompleto. Ahora planteamos las semirreacciones y damos valores a los coeficientes para balancear las masas.
Posteriormente encontraremos los electrones de
cada semirreacción con la ecuación general:
Donde (v) es el número estequiométrico del compuesto o del
electrón, positivo para productos y negativo para reactivos, (si) el subínbdice
del elemento en el compuesto y (z) el estado de oxidación del elemento
en el compuesto.
Debido a
que el número de electrones que fluyen en ambas en reacciones es el mismo, podemos
afirmar que las semi-reacciones ya se encuentran balanceadas para la carga, ni
siquiera tenemos la necesidad de ubicar la posición de los electrones. Pero, si
usted está interesado en saber cuál es la semi reacción de oxidación y cuál es
la de reducción, es muy sencillo:
si el número estequiométrico de
electrones es negativo entonces, esos electrones van del lado de los reactivos
y por ende el manganeso se reduce.
si el número estequiométrico de electrones es positivo entonces, esos electrones van del lado de los productos y por ende el cloro se oxida.
Ahora reemplazamos en la ecuación general y
terminamos de balancear por inspección simple. En ese caso el cloruro de hidrógeno es la única
fuente de hidrógenos y el agua es el único reservorio de hidrógenos en los
productos.
👉Temas: química, química general, balanceo de ecuaciones químicas, ley de la
conservación de la masa, balanceo de ecuaciones químicas, ley de la
conservación de la masa, Joseleg



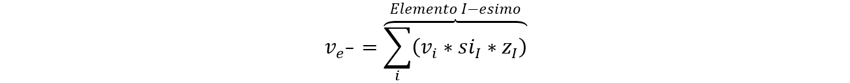




No hay comentarios:
Publicar un comentario