👉 𝑬𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐: A partir de estos datos,
S(rómbico) + O2(g) →
SO2(g) ∆H°rxn = -296.06 kJ/mol
S(monoclínico) + O2(g)
+ SO2(g) ∆H°rxn = -296.36 kJ/mol
… calcule
el cambio de entalpía para la transformación
S(rómbica) → S(monoclínica)
(Monoclínica
y rómbica son formas alotrópicas diferentes de azufre elemental).
|| Enlace a YouTube || Mas ejercicios resueltos
termoquímica || Mas ejercicios de otros
capítulos || Curso de termoquímica
|| ¡Si te gustó, suscríbete!
||
👉 𝑫𝒆𝒎𝒐𝒔𝒕𝒓𝒂𝒄𝒊𝒐𝒏𝒆𝒔 𝒚/𝒐 𝒄𝒐𝒏𝒄𝒆𝒑𝒕𝒐𝒔 𝒕𝒆ó𝒓𝒊𝒄𝒐𝒔:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-ley-hess.html
👉 𝑺𝒐𝒍𝒖𝒄𝒊ó𝒏: El S(rómbico) no lo
afecto debido a que lo necesito del lado de los reactivos con un coeficiente de
1, pero el S(monoclínico) le invierto el signo a la entalpía para poderlo usar
como producto. Luego aplicamos directo en la ley de Hess.
Dado que la formación del S(monoclínico)
absorbe energía del entorno, podemos afirmar que es menos estable que su
versión S(rómbico).
👉 𝑶𝒕𝒓𝒐𝒔 𝒆𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐𝒔: S(rómbico) + O2(g) → SO2(g) ∆H°rxn = -296.06
kJ/mol, S(monoclínico) + O2(g) + SO2(g) ∆H°rxn = -296.36 kJ/mol, calcule el
cambio de entalpía para la transformación S(rómbica) → S(monoclínica), Usando
la ley de Hess calcular la entalpia estándar de formación del azufre
monocíclico, Usando la ley de Hess calcular el calor de formación formación del
azufre monocíclico, Usando la ley de Hess, calcular el calor de formación
formación del azufre monocíclico
👉 𝑻𝒆𝒎𝒂𝒔: química, química general, Termoquímica,
joseleg, calor, entalpía, entalpía de la reacción, entalpía estándar de la
reacción, entalpía específica para una sustancia en la reacción, avance de la
reacción, ley de hess ejemplos, ley de hess ejercicios, ley de hess ejercicios
resueltos, ley de hess definición, ejercicios ley de Hess, entalpia termodinámica,
ejercicios de entalpía resueltos, ejercicios de entalpia

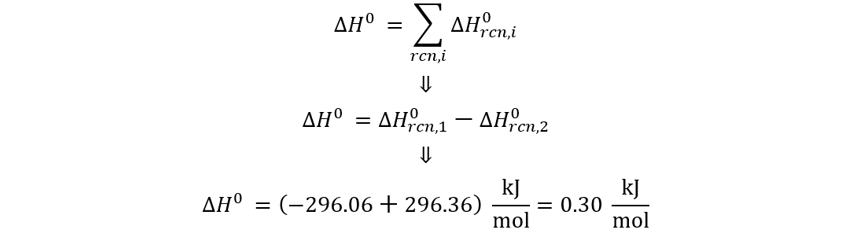

No hay comentarios:
Publicar un comentario