👉Enunciado: El primer paso en la recuperación industrial de zinc a partir del mineral de sulfuro de zinc es el tostado, es decir, la conversión de ZnS en ZnO por calentamiento: 2ZnS (s) + 3O2 (g) → 2ZnO (s) + 2SO2 (g) ∆H0 = -879 kJ/mol. Calcule el calor desprendido (en kJ) por gramo de ZnS.
|| Enlace a YouTube || Mas
ejercicios resueltos termoquímica || Mas
ejercicios de otros capítulos || Curso
de termoquímica || ¡Si te
gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/11/termoquimica-entalpia-reaccion.html
https://quimicadejoselegcuantitativa.blogspot.com/2022/02/Quimica-estandar-molar-especifica.html
👉Solución: Emplearemos la función que permite calcular la cantidad de calor de
una reacción en términos de la entalpía estándar y un radio de de-Donder. Luego
reemplazamos cantidad de sustancia por el cociente masa sobre masa molar y
despejamos el cociente de entalpía sobre masa.
Calculamos la masa
molar de la sustancia clave, que en este caso es el sulfuro de zinc.
Reemplazamos en la
ecuación.
👉Otros
enunciados: Determine el calor de reacción de 1 g de
ZnS en 2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2, Determinar el calor de reacción de 1
g de ZnS en 2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2, Calcule el calor de reacción de
1 g de ZnS en 2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2, Calcular el calor de reacción
de 1 g de ZnS en 2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2, Halle el calor de reacción
de 1 g de ZnS en 2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2, Hallar el calor de reacción
de 1 g de ZnS en 2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2,
👉Temas: química, química general, Termoquímica, joseleg, calor de reacción



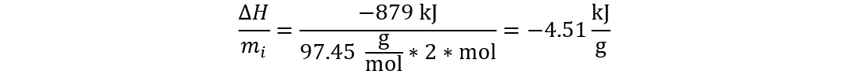

No hay comentarios:
Publicar un comentario