👉Enunciado: Se agregan 3.93 litros del anticongelante etilenglicol [CH2(OH)CH2(OH)] al radiador de un automóvil que contiene 6.50 L de agua para que esta no se congele a -20 °C? Calcule el punto de ebullición de esta mezcla de agua y etilenglicol. (La densidad del etilenglicol es 1.11 g/ml).
Mas
ejercicios resueltos de química sobre #propiedadesdelasdisoluciones. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #propiedadesdelasdisoluciones. ¡Si
te gustó, suscríbete!
👉Demostración de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/coligativas-abulloscopico-crioscopico.html
👉Solución: Podemos igualar las leyes de aumento ebulloscópico y descenso ebulloscópico por la concentración molal.
Reemplazamos utilizando los datos de la tabla de
constantes.
👉Otros enunciados: Cual es la temperatura
de ebullición de 3.93 L de etilenglicol em 6.5 L de agua, Determine la
temperatura de ebullición de 3.93 L de etilenglicol em 6.5 L de agua, Determinar
la temperatura de ebullición de 3.93 L de etilenglicol em 6.5 L de agua, Calcule
la temperatura de ebullición de 3.93 L de etilenglicol em 6.5 L de agua, Calcular
la temperatura de ebullición de 3.93 L de etilenglicol em 6.5 L de agua, Halle la
temperatura de ebullición de 3.93 L de etilenglicol em 6.5 L de agua, Hallar la
temperatura de ebullición de 3.93 L de etilenglicol em 6.5 L de agua,
👉Temas:
química, química general, disoluciones, propiedades de las disoluciones,
solubilidad, aumento ebulloscópico, descenso crioscópico,


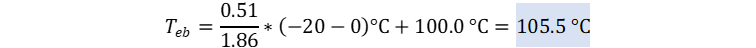

No hay comentarios:
Publicar un comentario