👉Enunciado: Una solución acuosa contiene el aminoácido glicina (NH2CH2COOH). Suponiendo que el ácido no se ioniza en agua, calcule la molalidad de la solución si se congela a -1.1 °C.
Mas
ejercicios resueltos de química sobre #propiedadesdelasdisoluciones. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #propiedadesdelasdisoluciones. ¡Si
te gustó, suscríbete!
👉Demostración de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/coligativas-abulloscopico-crioscopico.html
👉Solución: Dado que el
solvente es el benceno, buscaremos en la tabla las constantes de aumento
ebulloscópico y descenso crioscópico.
Con esto, la ecuación de descenso crioscópico, pero, despejando la
concentración molal del soluto. Dado que la glicina es un soluto no ionizable,
asumimos que su factor de van't Hoff
vale 1 y lo cancelamos analíticamente.
Reemplazamos.
👉Otros enunciados: Cual es la molalidad
de una solución de glicina si su descenso crioscópico es de 1.1°C, Determine la
molalidad de una solución de glicina si su descenso crioscópico es de 1.1°C, Determinar
la molalidad de una solución de glicina si su descenso crioscópico es de 1.1°C,
Calcule la molalidad de una solución de glicina si su descenso crioscópico es
de 1.1°C, Calcular la molalidad de una solución de glicina si su descenso crioscópico
es de 1.1°C, Halle la molalidad de una solución de glicina si su descenso crioscópico
es de 1.1°C, Hallar la molalidad de una solución de glicina si su descenso crioscópico
es de 1.1°C,
👉Temas:
química, química general, disoluciones, propiedades de las disoluciones,
solubilidad, aumento ebulloscópico, descenso crioscópico,



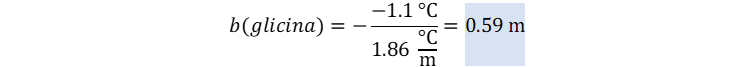

No hay comentarios:
Publicar un comentario