Enunciado ¿Qué volumen en mililitros de H2SO4 concentrado, 36.0 normal, debo tomar para preparar 1.00 litro de disolución al 1.00 molar? Enlace a YouTube
Mas
ejercicios resueltos de química sobre #unidadesdeconcentracion. Mas
ejercicios resueltos de otros capítulos de #química. Curso
de #unidadesdeconcentración. ¡Si
te gustó, suscríbete!
Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/unidades-concentracion-normalidad.html
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/cambios-concentracion.html
Solución:
Ya sabemos que el equivalente molar de la disociación completa del
ácido sulfúrico es de 2 eq/mol. Y al ser un problema de disolver una solución, asumimos
que la cantidad de sustancia es constante entre los dos momentos. Solo es
reemplazar el inicial por lo que vale en términos de la concentración
equivalente y el final por lo que vale en términos de la concentración molar y
despejar el volumen inicial.
Reemplazamos teniendo en cuenta que ni
molar ni normal nos sirven para hacer análisis dimensional por lo que ambas las
reemplazamos por sus unidades fundamentales mol/L y eq/L. Adicionalmente tenga
en cuenta que un litro equivale a 103 ml.
Otros
enunciados: mililitros de H2SO4 al 36 normal para preparar
1 litro al 1 molar, volumen de H2SO4 al 36 normal para preparar 1 litro al 1
molar, para preparar 1 litro al 1 molar cuantos mililitros de H2SO4 al 36
normal se necesitan, para preparar 1 litro al 1 molar cuanto volumen de H2SO4
al 36 normal se necesita, hallar el volumen inicial en concentración normal con
el volumen final y la concentración molar, con el volumen final y la
concentración molar hallar el volumen inicial en concentración normal con el
volumen final y la concentración molar
Temas: química, química general, unidades de
concentración, conversiones entre unidades de concentración, concentración
molar, molaridad, concentración normal, normalidad,



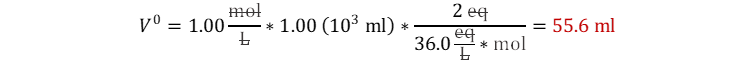

No hay comentarios:
Publicar un comentario