Enunciado Un recipiente contiene 750 ml de ZnCl2 0.500 N. Calcular la concentración molar. Peso-fórmula ZnCl2 = 136.4. Enlace a YouTube
Mas ejercicios resueltos de química
sobre #unidadesdeconcentracion. Mas ejercicios resueltos de otros
capítulos de #química. Curso de #unidadesdeconcentración. ¡Si
te gustó, suscríbete!
Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/unidades-concentracion-normalidad.html
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/unidades-concentracion-conversiones.html
Solución:
Planteamos la ecuación de disociación
iónica balanceada para masa y carga.
Elegimos
uno de los iones para analizar, digamos cloruro, su número estequiométrico es v = 2, y su número de carga es z = -1. Por lo que aplicamos la fórmula
de equivalente molar.
Buscamos
en la tabla de conversiones de unidades de concentración la fórmula para
calcular la molaridad con la normalidad.
Reemplazamos teniendo en cuenta que normal no sirve para hacer análisis dimensional, y en su lugar reemplazamos como eq/L
Otros
enunciados: molaridad
de ZnCl2 al 0.500 normal, molaridad de ZnCl2 con 0.500 equivalentes litro ZnCl2,
convertir 0.500 normal a molar, convertir de normal a molar, con 0.500 normal
obtener la molaridad, como se calcula la molaridad con 0.500 normal de ZnCl2,
conversión entre concentración normal a molar
Temas: química, química general, unidades de
concentración, conversiones entre unidades de concentración, concentración
molar, molar, molaridad, normal, normalidad, equivalente





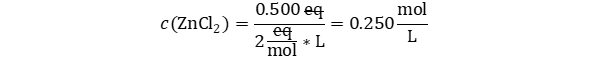

No hay comentarios:
Publicar un comentario