Mas
ejercicios resueltos de química sobre estequiometría:
Mas
ejercicios resueltos de otros capítulos de química:
https://cienciasdejoseleg.blogspot.com/2021/09/problemas-de-quimica-resueltos.html
Curso de
estequiometría analítica:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/estequiometria-analitica.html
Demostración
de las ecuaciones clave:
https://quimicadejoselegcuantitativa.blogspot.com/2021/08/estequiometria-nueva.html
Para ver directo en YouTube: https://youtu.be/yNpgtDotmok
Solución:
Usaremos
la ley de radio estequiométrico para dos sustancias, una que sirve como
incógnita (i) y otra que sirve como dato (d).
Despejamos
la cantidad de sustancia de la incógnita.
Reemplazamos
cantidad de sustancia (n) por el cociente masa dividido la masa molar (m/M),
y despejamos la masa de la incógnita.
Calculamos
las masas molares de las dos sustancias involucradas, siendo sus valores 32.07
g/mol de S y 64.07 g/mol de SO2. Reemplazamos y calculamos,
asumiendo que la incógnita es el azufre (S) y el dato es del SO2.
Por ende podemos concluir que hay 13 millones de
toneladas de azufre.



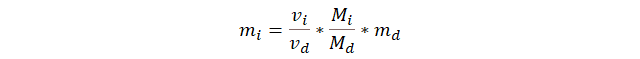


No hay comentarios:
Publicar un comentario